题目内容
17.铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现:将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.实验室现有下列试剂:0.01mol/L 酸性KMnO4溶液、0.10mol/L KI溶液、新制氯水、淀粉溶液、蒸馏水.请你协助他们探究所得溶液和气体的成分,并把答案填在相应空格上.【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有SO2、H2中的一种或两种.
【实验探究】
| , | 实验操作 | 预期现象 | 结 论 |
| 验证猜想I] | 步骤①:取少量0.01mol/L 酸性KMnO4溶液,滴入所得溶液中 | 溶液紫红色褪去 | 含有Fe2+ |
| 步骤②:另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | 不含Fe3+ | |
| 验证猜想Ⅱ | 将所得气体通入如下装置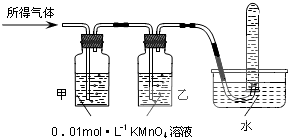 | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 | 含有两种气体 |
分析 【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,据此进行猜想;
【实验探究】
验证猜想Ⅰ、根据二价铁离子和三价铁离子的性质选择试剂,并根据反应物和生成物预测现象,由此得出结论;
验证猜想Ⅱ、根据氢气和二氧化硫的性质选择试剂,并预测现象,由现象得出结论.
解答 解:【提出猜想】浓硫酸和铁反应生成二氧化硫,稀硫酸和铁反应生成氢气,所以所得气体中可能含有SO2、H2,故答案为:SO2、H2;
【实验探究】
验证猜想Ⅰ、
酸性高锰酸钾有强氧化性,二价铁离子有还原性,所以酸性高锰酸钾能和二价铁离子发生氧化还原反应,如果步骤①溶液紫红色褪去,说明含有二价铁离子,否则没有.
碘化钾有还原性,三价铁离子有氧化性,碘离子和三价铁离子能发生氧化还原反应生成单质碘,碘遇淀粉变蓝色,所以步骤②另取少量所得溶液,滴加KI溶液和淀粉溶液,如果溶液变为蓝色,说明含有三价铁离子,否则没有,
猜想Ⅱ、
二氧化硫有还原性,能和强氧化性的物质发生氧化还原反应,如能使酸性高锰酸钾溶液褪色,氢气不能使酸性高锰酸钾溶液褪色,但氢气不易溶于水,所以如果甲中KMnO4溶液褪色,说明含有二氧化硫;乙中KMnO4溶液颜色不变,说明二氧化硫完全被吸收,如果试管中收集气体,只能是氢气,
故答案为:
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想I] | 溶液紫红色褪去 | ||
| 另取少量所得溶液,滴加KI溶液和淀粉溶液 | 溶液不变为蓝色 | ||
| 验证猜想Ⅱ | 甲中KMnO4溶液褪色,乙中KMnO4溶液颜色不变,试管中收集到气体 |
点评 本题考查了二价铁离子和三价铁离子的检验,为高频考点,侧重于学生的分析能力和实验设计能力的考查,难度不大,注意常温下,浓硫酸和铁能发生钝化现象,钝化现象是铁和浓硫酸反应生成一层致密的氧化物薄膜,不是不反应.

练习册系列答案
相关题目
16.下列叙述正确的是( )
| A. | 任何浓度的溶液都可以用pH来表示其酸碱性的强弱 | |
| B. | 某溶液中由水电离出的c(OH-)=1×10-a mol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| D. | 无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)•c(OH-)=1×10-14 |
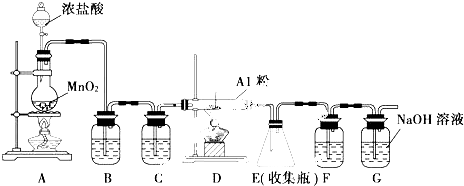
 ,其中氧化剂是MnO2,还原剂是HCl.
,其中氧化剂是MnO2,还原剂是HCl.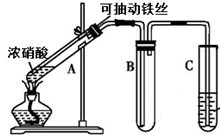 某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.
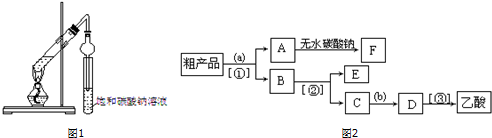
某校化学兴趣小组利用如图所示装置进行探究铁与浓硝酸的反应.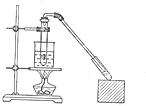 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边搅动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
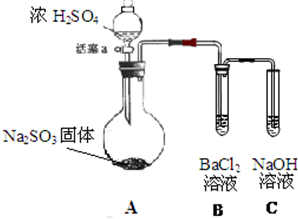 某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):
某同学设计了如下实验装置图.(夹持装置和加热装置略,气密性已检验):