题目内容
17.对于某些离子和物质的检验及结论一定正确的是( )| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
分析 A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,二氧化碳气体遇澄清石灰水变浑浊;
B、湿润红色石蕊试纸遇碱性物质变蓝;
C、加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,可能有SO42-;
D、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀.
解答 解:A、盐酸能与含碳酸根或碳酸氢根离子的物质反应生成二氧化碳,加入稀盐酸产生无色气体,不一定有CO32-,故A错误;
B、湿润红色石蕊试纸遇碱性物质变蓝,加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定是氨气产生,一定有NH4+,故B正确;
C、加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,可能有SO42-,故C错误;
D、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-,故D错误;
故选B.
点评 本题考查了常见离子的检验,完成此题,可以依据已有的知识进行解答.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
17.根据如图回答,下列说法正确的是( )
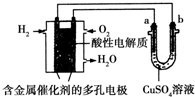

| A. | 此装置用于铁表面镀铜时,a为铁 | |
| B. | 此装置用于电镀铜时,硫酸铜溶液的浓度减小 | |
| C. | 燃料电池中正极反应为$\frac{1}{2}$O2+2e-+H2O═2OH- | |
| D. | 若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜 |
5.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4的浓度,化学反应速率增大;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=1.5×10-2mol/(L•min);
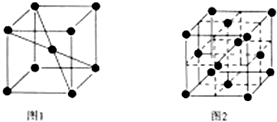
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图l所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
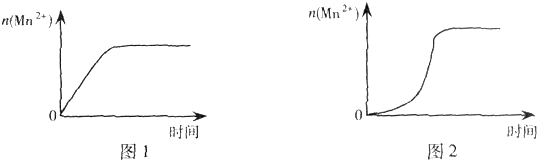
①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②请你帮助该小组同学完成实验方案,并填写表中空白.
③若该小组同学提出的假设成立,应观察到的现象是与实验1比较,溶液褪色所需时间短(或所用时间(t)小于4min).
【原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是其他条件相同时,增大KMnO4的浓度,化学反应速率增大;
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率为:v(KMnO4)=1.5×10-2mol/(L•min);
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图l所示.但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.

①该小组同学提出的假设是生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②请你帮助该小组同学完成实验方案,并填写表中空白.
| 实验 编号 | 室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
12.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如图实验:
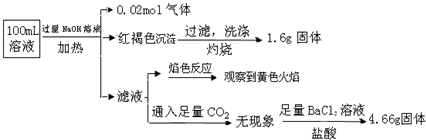
由此可知原溶液中( )

由此可知原溶液中( )
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
7.下列各项比较错误的是( )
| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |

 ;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基.
;E的分子式为C10H12O2;F中含氧官能团的名称是酯基、醛基. .
.