题目内容
6.表为长式周期表的一部分,其中的编号代表对应的元素.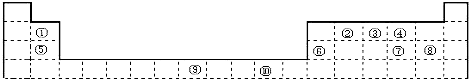
(1)表中位于ds区的元素是⑩(填编号),写出该元素基态原子的电子排布式[Ar]3d104s1.
(2)①和⑧形成的化合物分子中,中心原子的杂化轨道类型为sp,⑥和⑧形成的化合物的晶体类型是分子晶体.
(3)②、③、④三种元素中,第一电离能最大的是②(填编号).
(4)元素③的简单气态氢化物在水中的溶解度比同族其它元素的氢化物大得多的原因是分子之间形成氢键.
(5)⑤与④形成的晶体的熔点高于⑤与⑦形成的晶体熔点,原因是氧离子半径小于硫离子半径,则MgO中离子键短,键能大.
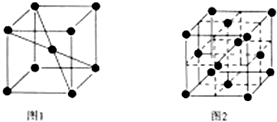
(6)1183K以下,元素⑨的单质为体心立方晶体(晶胞结构如图1),1183K以上转变为面心立方晶体(晶胞结构如图2).在图2中,与一个原子距离最近且相等的原子个数为12,图1与图2所示晶胞中含有的原子个数之比为1:2.
分析 由元素在周期表的位置可知,①为Be,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为Cu,
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,故符合的为⑩元素铜;
(2)①和⑧形成的化合物为BeCl2;⑥和⑧形成的化合物为AlCl3;
(3)N原子的2p电子半满为稳定结构,则第一电离能大;
(4)元素③的简单气态氢化物为氨气,易与水分子形成氢键;
(5)⑤与④形成的晶体(MgO)的熔点高于⑤与⑦形成的晶体(MgS)熔点,与离子键有关;
(6)在1183K以下,为图1所示,可知体心中有一个原子周围有八个原子,故每个晶胞中有8个原子与中心原子等距离且最近,在晶体中依然为8个,在1183K以上时为图2所示,以最上面中间原子为为例,同一个平面上有4个原子距离相等且距离最小,在竖直方向的四个面上,中间原子与所选定原子等距离且距离最小,在晶体中晶胞重复出现,故对面会有对称的四个竖直面上的点,一共12个,结合均摊法计算.
解答 解:由元素在周期表的位置可知,①为Be,②为C,③为N,④为O,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为Fe,⑩为Cu,
(1)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,故符合的为⑩元素铜,该元素基态原子的电子排布式为[Ar]3d104s1,故答案为:⑩;[Ar]3d104s1;
(2)①和⑧形成的化合物为BeCl2,Be不含孤对原子,形成2个共价单键,则中心原子的杂化轨道类型为sp杂化,⑥和⑧形成的化合物为AlCl3,由分子构成,为分子晶体,故答案为:sp;分子晶体;
(3)N原子的2p电子半满为稳定结构,则第一电离能大,②、③、④三种元素中,第一电离能最大的是②,故答案为:②;
(4)元素③的简单气态氢化物为氨气,易与水分子形成氢键,则元素③的简单气态氢化物在水中的溶解度比同族其它元素的氢化物大得多的原因是分子之间形成氢键,故答案为:分子之间形成氢键;
(5)⑤与④形成的晶体(MgO)的熔点高于⑤与⑦形成的晶体(MgS)熔点,原因为氧离子半径小于硫离子半径,则MgO中离子键短,键能大,
故答案为:氧离子半径小于硫离子半径,则MgO中离子键短,键能大;
(6)由图1可知,与体心原子距离最近的原子位于顶点,则有8个;由图2可知,与顶点原子距离最近的原子位于面心,1个晶胞中有3个,空间有8个晶胞无隙并置,且1个面被2个晶胞共用,则与一个原子距离最近且相等的原子个数为$\frac{3×8}{2}$=12个,图1与图2所示晶胞中含有的原子个数之比为(1+8×$\frac{1}{8}$):(6×$\frac{1}{2}$+8×$\frac{1}{8}$)=1:2,
故答案为:12;1:2.
点评 本题考查晶胞计算及原子结构,为高频考点,涉及电子排布及杂化、元素周期表中元素的分区、元素周期表中元素的位置、晶胞及晶体中原子个数的计算等,综合性较强,题目难度较大.

| A. | 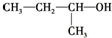 2-甲基-1-丙醇 | B. | 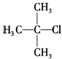 2-甲基-2-氯丙烷 | C. | 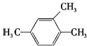 1,3,4-三甲苯 | D. | 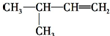 2-甲基-3-丁烯 |
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.(1)臭氧是理想的烟气脱硝试剂,已知:
4NO2(g)+O2(g)?2N2O5(g)△H=-56.70kJ•mol-1
3O2(g)?2O3(g)△H=+28.80kJ•mol-1
则脱硝反应2NO2(g)+O3(g)?N2O5(g)+O2(g)的△H=-42.75kJ•mol-1kJ•mol-1.
(2)若脱硝反应在恒容密闭容器中进行,下列说法正确的是abd.
a.升高温度,平衡常数减小
b.增大O3量可以提高NO2转化率
c.降低温度,既能提高NO2的转化率,又能加快反应速率
d.如图所示,t1时使用了催化剂
(3)某实验小组模拟合成甲醇的过程,将6molCO2和8molH2充入一容积为2L的密闭容器中,发生反应CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H=-49.0kJ•mol-1.测得H2的物质的量随时间变化如下表所示,回答下列问题:
| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
(4)根据阿伦尼乌斯公式可知.化学反应速率常数随温度变化的关系为k=Ae(-Ea/Rr)(其中Ea为活化能,R为常量,A为大于零的常数),在相同温度下,活化能Ea越大,化学反应速率常数k越小(填“越大”或“越小”)
(5)某研究小组用熔断Li2CO3作电解质,电解还原CO2制石墨,电解过程中阴极的电极反应式3CO2+4e-=C+CO32-.
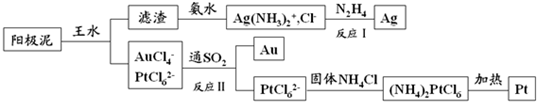
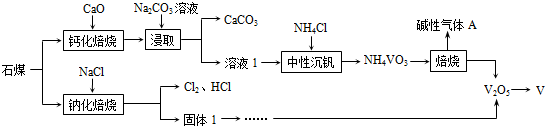
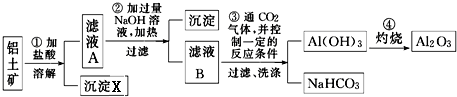
 .
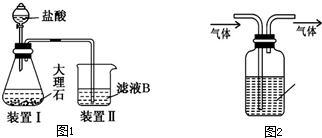
.
 ②
② ③
③ ④TNT
④TNT