题目内容
7.下列各项比较错误的是( )| A. | 微粒半径:r(Na+)>r(Mg2+)>r(Al3+) | B. | 酸性强弱:HClO>H2SO3>H3PO4 | ||
| C. | 稳定性:HF>H2O>H2S | D. | 碱性强弱:Pb(OH)4>Sn(OH)4>Ge(OH)4 |
分析 A.具有相同电子排布的离子,原子序数大的离子半径小;
B.非金属性越强,对应最高价氧化物水化物的酸性越强;
C.非金属性越强,氢化物越稳定;
D.金属性越强,对应最高价氧化物水化物的碱性越强.
解答 解:A.具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为r(Na+)>r(Mg2+)>r(Al3+),故A正确;
B.非金属性越强,对应最高价氧化物水化物的酸性越强,而HClO、H2SO3均为弱酸,只有H3PO4为最高价含氧酸,H3PO4为中强酸,故B错误;
C.非金属性F>O>S,稳定性为HF>H2O>H2S,故C正确;
D.金属性Pb>Sn>Ge,对应最高价氧化物水化物的碱性为Pb(OH)4>Sn(OH)4>Ge(OH)4,故D正确;
故选B.
点评 本题考查周期表和周期律,为高频考点,把握元素的性质及周期律为解答的关键,侧重分析与应用能力的考查,注意短周期元素的性质比较及规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
17.对于某些离子和物质的检验及结论一定正确的是( )
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
2.一定温度下反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
12.已知25℃时有关弱酸的电离平衡常数:弱酸化学式 CH3COOH HCN H2CO3电离平衡常数(25℃)1.8×l0-54.9×l0-10K1=4.3×l0-7 K2=5.6×l0-11则下列有关说法正确的是( )
| A. | 将a molL-1 HCN溶液与a molL-1 NaOH溶液等体积混合,混合液中:c(OH-)>c(H+),c(Na+)>c(CN-) | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 | |
| D. | NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) |
19.下列各选项从左至右按互为同位素、互为同系物、互为同分异构体、互为同素异形体、是同种物质顺序排列的是( )
①C60、C70、金刚石、石墨
②C2H5OH、CH3OCH3
③${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$
④HOCH2COOH、HOCH2CH2COOH、HOCH2CH2CH2COOH
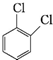
⑤ 、
、
①C60、C70、金刚石、石墨
②C2H5OH、CH3OCH3
③${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$
④HOCH2COOH、HOCH2CH2COOH、HOCH2CH2CH2COOH
⑤
 、
、
| A. | ①②③⑤④ | B. | ③⑤④①② | C. | ④②①⑤③ | D. | ③④②①⑤ |
17.已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,下列反应放热为57.3kJ的是( )
| A. | 1mol稀H2SO4与足量NaOH溶液反应 | |
| B. | 稀醋酸与NaOH溶液反应生成1mol H2O | |
| C. | 稀盐酸与稀Ba(OH)2溶液反应生成1mol H2O | |
| D. | 稀NaOH与95%浓硫酸反应生成1mol H2O |
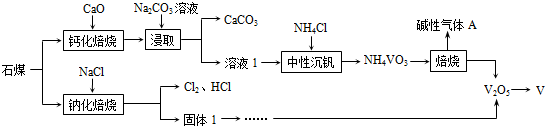
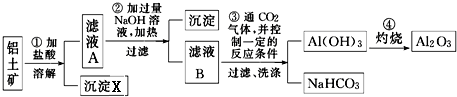
 .
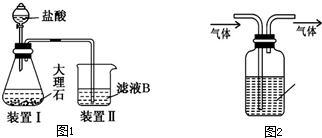
.
 ②
② ③
③ ④TNT
④TNT