题目内容
图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.

(1)B中若收集到224mL气体(标准状况),则溶解的金属质量为
(2)C中被腐蚀的金属是 (填化学式),A、B、C中铁被腐蚀的速率,由快到慢的是顺序是 (用“>”表示).

(1)B中若收集到224mL气体(标准状况),则溶解的金属质量为
(2)C中被腐蚀的金属是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)该装置构成原电池,电池反应式为Fe+2H+=Fe2++H2↑,根据转移电子相等计算;
(2)该装置中锌易失电子被腐蚀,金属腐蚀快慢顺序:原电池负极>化学腐蚀>原电池正极.
(2)该装置中锌易失电子被腐蚀,金属腐蚀快慢顺序:原电池负极>化学腐蚀>原电池正极.
解答:
解:(1)该装置构成原电池,电池反应式为Fe+2H+=Fe2++H2↑,生成的气体是氢气,氢气的物质的量=
=0.01mol,转移电子的物质的量=0.01mol×2=0.02mol,根据转移电子相等得溶解的铁质量=
×56g/mol=0.56g,故答案为:0.56g;
(2)该装置中锌易失电子被腐蚀,金属腐蚀快慢顺序:原电池负极>化学腐蚀>原电池正极,A中铁发生化学腐蚀,B中铁作负极加速被腐蚀,C中铁作正极被保护,所以铁被腐蚀快慢顺序是B>A>C,
故答案为:Zn;B>A>C.
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 2 |
(2)该装置中锌易失电子被腐蚀,金属腐蚀快慢顺序:原电池负极>化学腐蚀>原电池正极,A中铁发生化学腐蚀,B中铁作负极加速被腐蚀,C中铁作正极被保护,所以铁被腐蚀快慢顺序是B>A>C,
故答案为:Zn;B>A>C.
点评:本题考查了金属的腐蚀与防护、根据方程式的计算,知道金属腐蚀快慢的判断方法,再结合转移电子相等进行计算,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列化工生产过程中发生的反应,不属于氧化还原反应的是( )
| A、用氨气制硝酸 |
| B、用石灰石制生石灰 |
| C、用氯气制漂白粉 |
| D、从卤水中提取溴单质 |
 如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中不正确的是( )| A、X电极是阴极 |
| B、Y电极产生气体的体积为0.224L |
| C、电解后溶液的pH=1 |
| D、要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质与稀盐酸反应的速率为L>Q |
| C、M与T形成的化合物具有两性 |
| D、L2+与R2-的核外电子数相等 |
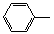 -CH=CH2)和D(HO-
-CH=CH2)和D(HO-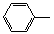 -CHO)按如下方法合成:
-CHO)按如下方法合成: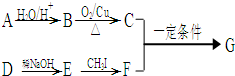
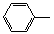 -ONa+RCH2I→
-ONa+RCH2I→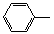 -OCH2R
-OCH2R