题目内容
4.电化学在日常生活中用途广泛,图甲是镁--次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )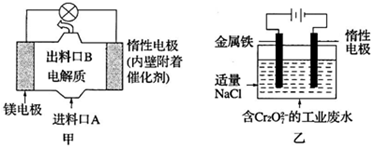
| A. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 | |
| B. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓ | |
| C. | 图乙电解池中,若有0.84g阳极材料参与反应,则阴极会有3.36L的气体产生 | |
| D. | 若图甲燃料电池消耗0.36g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
分析 A.图乙中惰性电极为阴极,Cr2O72-阳极移动;
B.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应;
C.图乙的电解池中,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,以此计算.
解答 解:A.图乙中惰性电极为阴极,Fe电极为阳极,则Cr2O2-7离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故A错误;
B.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应为Mg-2e-=Mg2+,电池反应式为Mg+ClO-+H2O=Mg(OH)2↓+Cl-,正极上次氯酸根离子得电子发生还原反应,则总反应减去负极反应可得正极还原反应为Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2↓,故B正确;
C.图乙的电解池中,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑,则n(Fe)=$\frac{0.84g}{56g/mol}$=0.015mol,阴极气体在标况下的体积为0.015mol×22.4L/mol=0.336L=3.36mL,而状况不知,故C错误;
D.由电子守恒可知,Mg~2e-~Fe2+,由原子守恒可知Fe2+~Fe(OH)3↓,则n(Mg)=$\frac{0.36g}{24g/mol}$=0.015mol,理论可产生氢氧化铁沉淀的质量为0.015mol×107g/mol=1.605g,故D错误;
故选B.
点评 本题考查电解原理,涉及电解、氧化还原反应、电子守恒的计算等问题,要求具有较好的分析和解决问题的能力,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 天津港爆炸案对剧毒的氰化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| D. | 利用加热的方法杀死人体内感染的埃博拉病毒 |
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
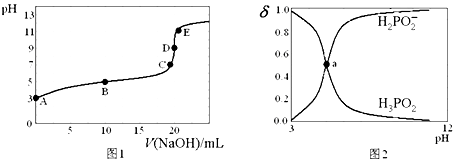
| A. | H3PO2的电离方程式为H3PO2?H2PO2-+H+ Ka≈10-5 | |
| B. | B点时,溶液中存在关系:2c(H+)+c(H2PO2-)═2c(OH-)+c(H3PO2) | |
| C. | C点时,溶液中存在关系:c(Na+)+c(H+)═c(H2PO2-)+c(OH-) | |
| D. | D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
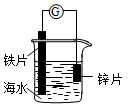
| A. | 锌片发生氧化反应作阴极 | |
| B. | 电子从铁片经过导线流向锌片 | |
| C. | 铁片上电极反应为:O2+2H2O+4e→4OH- | |
| D. | 该装置可用于研究外加电流阴极保护法 |
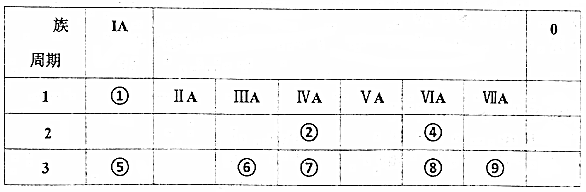
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.