题目内容
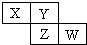 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,由元素在周期表中位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,最外层电子数为6,所以Y为O元素,则X为N元素,Z为S元素,W为Cl元素.
A.同周期自左而右非金属性增强,非金属性越强,氢化物越稳定;
B.NO不溶于水;
C.同主族自上而下非金属性减弱;
D.同周期随原子序数增大原子半径增大,电子层越多原子半径越大.
A.同周期自左而右非金属性增强,非金属性越强,氢化物越稳定;
B.NO不溶于水;
C.同主族自上而下非金属性减弱;
D.同周期随原子序数增大原子半径增大,电子层越多原子半径越大.
解答:
解:X、Y、Z、W均为短周期元素,由元素在周期表中位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是内层电子数的3倍,最外层电子数为6,所以Y为O元素,则X为N元素,Z为S元素,W为Cl元素.
A.同周期自左而右非金属性增强,非金属性Y>X,非金属性越强,氢化物越稳定,故氢化物稳定性:Y>X,故A错误;
B.NO不溶于水,故B错误;
C.同主族自上而下非金属性减弱,故非金属性Z<Y,故C正确;
D.同周期随原子序数增大原子半径增大,电子层越多原子半径越大,故原子半径Z>W>X>Y,故D错误,
故选C.
A.同周期自左而右非金属性增强,非金属性Y>X,非金属性越强,氢化物越稳定,故氢化物稳定性:Y>X,故A错误;
B.NO不溶于水,故B错误;
C.同主族自上而下非金属性减弱,故非金属性Z<Y,故C正确;
D.同周期随原子序数增大原子半径增大,电子层越多原子半径越大,故原子半径Z>W>X>Y,故D错误,
故选C.
点评:本题考查结构性质位置关系应用,侧重对元素周期律的考查,难度不大,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
实验室用石灰石和盐酸制取CO2时,最佳的除杂试剂和方法是( )
| A、水、浓H2SO4、洗气 |
| B、饱和Na2CO3溶液、浓H2SO4、洗气 |
| C、NaOH溶液、浓H2SO4、洗气 |
| D、饱和NaHCO3溶液、浓H2SO4、洗气 |
若20g密度为d g/cm3的Ca(NO3)2溶液里含有2g Ca2+则NO3-离子的物质的量浓度是( )
| A、2d mol/L |
| B、4d mol/L |
| C、5d mol/L |
| D、2.5d mol/L |
0.1mol/L的亚硫酸钠溶液15mL,恰好将1×10-3mol的XO4-离子还原,则X在还原产物中的化合价是( ) 价.
| A、+1 | B、+2 | C、+3 | D、+4 |
下列实验操作正确的是( )
| A、用CCl4萃取碘水中的碘,上层的水从分液漏斗的下端放出 |
| B、配制溶液时,摇匀后发现液面低于刻度,再加水至刻度线 |
| C、把溶液从烧杯中转移到容量瓶时用玻璃棒引流 |
| D、称量时,托盘天平的左盘放砝码,右盘放称量药品 |
室温时,下列混合溶液的pH一定小于7的是( )
| A、pH=3的盐酸和pH=11的氨水等体积混合 |
| B、pH=1的硫酸和0.2 mol/L的氢氧化钠溶液等体积混合 |
| C、pH=3的醋酸和 pH=11 的氢氧化钠溶液等体积混合 |
| D、0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合 |
下列说法正确的是( )
| A、将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C、强电解质溶液的导电能力一定比弱电解质溶液强 |
| D、中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需NaOH的物质的量相等 |