题目内容
室温时,下列混合溶液的pH一定小于7的是( )
| A、pH=3的盐酸和pH=11的氨水等体积混合 |
| B、pH=1的硫酸和0.2 mol/L的氢氧化钠溶液等体积混合 |
| C、pH=3的醋酸和 pH=11 的氢氧化钠溶液等体积混合 |
| D、0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合 |
考点:pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A.一水合氨为弱电解质,pH=3的盐酸中氯化氢浓度为0.001mol/L,而pH=11的氨水中一水合氨浓度远远大于0.01mol/L,等体积混合后氨水过量,溶液显示碱性;
B.硫酸和氢氧化钠都是强电解质,pH=1的硫酸中氢离子浓度为0.1mol/L,两溶液混合后氢氧化钠过量,溶液显示碱性;
C.醋酸为弱酸,溶液中部分电离出氢离子,pH=3的醋酸中醋酸浓度大于0.001mol/L,pH=11的氢氧化钠溶液的浓度为0.001mol/L,两溶液混合醋酸过量,溶液显示酸性;
D.0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合,恰好生成硫酸铵,铵根离子水解,溶液显示酸性.
B.硫酸和氢氧化钠都是强电解质,pH=1的硫酸中氢离子浓度为0.1mol/L,两溶液混合后氢氧化钠过量,溶液显示碱性;
C.醋酸为弱酸,溶液中部分电离出氢离子,pH=3的醋酸中醋酸浓度大于0.001mol/L,pH=11的氢氧化钠溶液的浓度为0.001mol/L,两溶液混合醋酸过量,溶液显示酸性;
D.0.1 mol/L的硫酸和0.2 mol/L的氨水等体积混合,恰好生成硫酸铵,铵根离子水解,溶液显示酸性.
解答:
解:A.一水合氨为弱电解质,溶液中只能部分电离出氢氧根离子,pH=3的盐酸中氯化氢浓度为0.001mol/L,而pH=11的氨水中一水合氨浓度远远大于0.01mol/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH一定大于7,故A错误;
B.pH=1的硫酸中氢离子为0.1mol/L,与0.2 mol/L的氢氧化钠溶液等体积混合后氢氧化钠过量,溶液显示碱性,溶液的pH大于7,故B错误;
C.pH=3的醋酸中,醋酸的物质的量浓度大于0.001mol/L,pH=11的氢氧化钠溶液中氢氧化钠的浓度为0.001mol/L,两溶液等体积混合后醋酸过量,溶液显示酸性,溶液的pH一定小于7,故C正确;
D.0.1 mol/L的硫酸中氢离子浓度为0.2mol/L,与0.2 mol/L的氨水等体积混合后,恰好生成硫酸铵,由于铵根离子水解,溶液显示酸性,溶液的pH一定小于7,故D正确;
故选CD.
B.pH=1的硫酸中氢离子为0.1mol/L,与0.2 mol/L的氢氧化钠溶液等体积混合后氢氧化钠过量,溶液显示碱性,溶液的pH大于7,故B错误;
C.pH=3的醋酸中,醋酸的物质的量浓度大于0.001mol/L,pH=11的氢氧化钠溶液中氢氧化钠的浓度为0.001mol/L,两溶液等体积混合后醋酸过量,溶液显示酸性,溶液的pH一定小于7,故C正确;
D.0.1 mol/L的硫酸中氢离子浓度为0.2mol/L,与0.2 mol/L的氨水等体积混合后,恰好生成硫酸铵,由于铵根离子水解,溶液显示酸性,溶液的pH一定小于7,故D正确;
故选CD.
点评:本题考查了溶液酸碱性与溶液pH的关系、盐的水解原理,题目难度中等,注意熟练掌握溶液酸碱性与溶液pH的关系,明确盐的水解原理及其应用方法,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法正确的是( )
| A、在吸热反应中,反应物的总能量比生成物的总能量高 |
| B、应用盖斯定律可以计算某些难以测量的反应焓变 |
| C、需要加热的化学反应都是吸热反应 |
| D、盐类的水解反应是放热反应 |
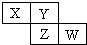 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
下列化学用语书写正确的是( )
| A、次氯酸的电离方程式:HClO?H++ClO- |
| B、铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑ |
| C、电解精炼铜的阴极反应式:Cu-2e-=Cu2+ |
| D、已知中和热为57.3 kJ?mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=-57.3 kJ?mol-1 |
一定条件下,在容积为10L的密闭容器中,将l mol X和1mol Y进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,下列说法正确的是( )
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |






 80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:
80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据: