题目内容
0.1mol/L的亚硫酸钠溶液15mL,恰好将1×10-3mol的XO4-离子还原,则X在还原产物中的化合价是( ) 价.
| A、+1 | B、+2 | C、+3 | D、+4 |
考点:氧化还原反应的计算
专题:计算题
分析:根据n=cV计算出亚硫酸钠溶液中亚硫酸钠的物质的量,亚硫酸钠被氧化成硫酸钠,化合价升高2价;设X被还原后的化合价为+x,XO4-离子中X的化合价为+7,则化合价降低了(7-x)价,根据氧化还原反应中化合价变化相等计算出x即可.
解答:
解:亚硫酸钠的物质的量为:n(Na2SO3)=0.1mol/L×0.015L=0.0015mol,
反应中Na2SO3为还原剂,SO32-中的+4价S被氧化为+6价的SO42-,化合价升高:(6-4)=2,化合价升高的物质的量为:0.0015mol×2=0.003mol,
XO4-为氧化剂,X元素化合价为为+7价,XO4-离子的物质的量为1×10-3mol,X的化合价变化为:
=3,
X元素化合价降低了3价,即从+7价降到+4价,
故选D.
反应中Na2SO3为还原剂,SO32-中的+4价S被氧化为+6价的SO42-,化合价升高:(6-4)=2,化合价升高的物质的量为:0.0015mol×2=0.003mol,
XO4-为氧化剂,X元素化合价为为+7价,XO4-离子的物质的量为1×10-3mol,X的化合价变化为:
| 0.003mol |
| 1×10-3mol |
X元素化合价降低了3价,即从+7价降到+4价,
故选D.
点评:本题考查学生氧化还原反应中的电子守恒思想的应用知识,题目难度中等,注意氧化还原反应的本质及特征,明确氧化还原反应中化合价升降相等是解答本题的关键.

练习册系列答案
 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
下列叙述不正确的是( )
| A、由分子构成的物质其熔点一般较低 |
| B、分子晶体在熔化时,共价键没有被破坏 |
| C、分子晶体中一定存在共价键 |
| D、分子晶体中分子间作用力越大,其化学性质越稳定 |
如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )


| A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 |
| B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 |
| C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 |
| D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 |
下列说法正确的是( )
| A、在吸热反应中,反应物的总能量比生成物的总能量高 |
| B、应用盖斯定律可以计算某些难以测量的反应焓变 |
| C、需要加热的化学反应都是吸热反应 |
| D、盐类的水解反应是放热反应 |
下列叙述正确的是( )
| A、汽油、柴油和植物油都是碳氢化合物 |
| B、纤维素、淀粉、蛋白质在一定条件下都能发生水解反应 |
| C、石油的分馏和煤的干馏都是物理变化 |
| D、苯环内含有碳碳单键和碳碳双键 |
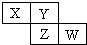 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
一定条件下,在容积为10L的密闭容器中,将l mol X和1mol Y进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,下列说法正确的是( )
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |