题目内容
下列说法正确的是( )
| A、将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C、强电解质溶液的导电能力一定比弱电解质溶液强 |
| D、中和等体积、等物质的量浓度的盐酸和醋酸溶液,所需NaOH的物质的量相等 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、氢氧化钠是强碱,完全电离,氨水是弱碱,部分电离,加水会促进电离平衡右移;
B、醋酸是一元弱酸,其中氢离子浓度小于酸的浓度;
C、电解质溶液的导电能力受离子浓度大小的影响;
D、中和盐酸和醋酸需要的氢氧化钠的体积和酸的物质的量的大小有关.
B、醋酸是一元弱酸,其中氢离子浓度小于酸的浓度;
C、电解质溶液的导电能力受离子浓度大小的影响;
D、中和盐酸和醋酸需要的氢氧化钠的体积和酸的物质的量的大小有关.
解答:
解:A、将NaOH溶液和氨水溶液各稀释一倍,氢氧化钠的OH-浓度减小到原来的一半,但是氨水的OH-浓度要比原来的一半大,故A错误;
B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度比醋酸的两倍还要大,故B错误;
C、电解质溶液的导电能力受离子浓度大小的影响,和电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故C错误;
D、等体积、等物质的量浓度的盐酸和醋酸溶液物质的量是一样的,二者所需NaOH的物质的量相等,故D正确.
故选D.
B、如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度比醋酸的两倍还要大,故B错误;
C、电解质溶液的导电能力受离子浓度大小的影响,和电解质的强弱无关,强电解质溶液的导电能力不一定比弱电解质溶液强,故C错误;
D、等体积、等物质的量浓度的盐酸和醋酸溶液物质的量是一样的,二者所需NaOH的物质的量相等,故D正确.
故选D.
点评:本题考查学生弱电解质在水溶液中的电离平衡知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )


| A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 |
| B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 |
| C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 |
| D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 |
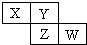 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
一定条件下,在容积为10L的密闭容器中,将l mol X和1mol Y进行如下反应:2X(g)+Y(g)?Z(g),经60s达到平衡生成0.3mol的Z,下列说法正确的是( )
| A、60 s内X的平均反应速率为0.001 mol?L-1?s-1 | ||
B、将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的
| ||
| C、若温度和体积不变,往容器内增加1 mol X,X的转化率将增大 | ||
| D、若升高温度,X的体积分数增大,则正反应的△H>0 |
能用勒夏特列原理解释的是( )
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、工业上合成NH3反应使用催化剂 |
| C、实验室可以采用排饱和食盐水收集Cl2 |
| D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
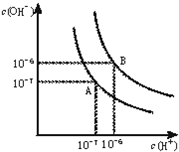 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.