题目内容
把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nZ(g)+2W(g).2min 末已生成0.2mol W,若测知以Z的浓度变化表示的反应速率为0.1mol?L-1?min-1,计算:
(1)前2min内用X的浓度变化表示的平均反应速率.
(2)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
(1)前2min内用X的浓度变化表示的平均反应速率.
(2)2min末时Y的浓度.
(3)化学反应方程式中n的值是多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:(1)根据v=
计算平均反应速率;
(2)根据化学方程式计算Y的物质的量,结合c=
计算得到浓度;
(3)根据反应速率之比等于化学计量数之比计算.
| △c |
| △t |
(2)根据化学方程式计算Y的物质的量,结合c=
| n |
| V |
(3)根据反应速率之比等于化学计量数之比计算.
解答:
解:利用三段式法计算:
2X(g)+Y(g)=nZ(g)+2W(g)
起始:0.6mol 0.6mol 0 0
转化:0.2mol 0.1mol 0.1nmol 0.2mol
平衡:0.4mol 0.5mol 0.1nmol 0.2mol
(1)由反应速率之比等于化学计量数之比可知:v(X)=v(W)=0.05mol/(L?min),答:前2min内X的平均反应速率为0.05 mol?L-1?min-1;
(2)平衡时Y的物质的量为0.5mol,则c(Y)=
=0.25mol/L,答:2min末时Y的浓度为0.25 mol?L-1;
(3)v(W)=
=0.05mol/(L?min),c(Z)=0.1mol/(L?min),由反应速率之比等于化学计量数之比可知:n:2=0.1mol/(L?min):0.05mol/(L?min),n=4,
答:化学反应方程式中n的值为4.
2X(g)+Y(g)=nZ(g)+2W(g)
起始:0.6mol 0.6mol 0 0
转化:0.2mol 0.1mol 0.1nmol 0.2mol
平衡:0.4mol 0.5mol 0.1nmol 0.2mol
(1)由反应速率之比等于化学计量数之比可知:v(X)=v(W)=0.05mol/(L?min),答:前2min内X的平均反应速率为0.05 mol?L-1?min-1;
(2)平衡时Y的物质的量为0.5mol,则c(Y)=
| 0.5mol |
| 2L |
(3)v(W)=
| ||
| 2min |
答:化学反应方程式中n的值为4.
点评:本题考查化学平衡的计算,题目难度不大,注意利用三段式法计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
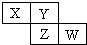 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |
 80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:
80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据: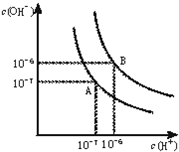 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.