题目内容
实验室用石灰石和盐酸制取CO2时,最佳的除杂试剂和方法是( )
| A、水、浓H2SO4、洗气 |
| B、饱和Na2CO3溶液、浓H2SO4、洗气 |
| C、NaOH溶液、浓H2SO4、洗气 |
| D、饱和NaHCO3溶液、浓H2SO4、洗气 |
考点:物质的分离、提纯和除杂
专题:
分析:HCl与饱和碳酸氢钠反应,而二氧化碳不反应,二氧化碳可用浓硫酸干燥.
解答:
解:A.二氧化碳在水中的溶解度较大,将原物质除掉,故A错误;
B.二氧化碳能与碳酸钠反应生成碳酸氢钠,将原物质除掉,故B错误;
C.二氧化碳和酸都与NaOH溶液反应,将原物质除掉,故C错误;
D.CO2气体混有HCl杂质,可选饱和NaHCO3溶液为除杂试剂,然后用浓硫酸洗气干燥,故D正确.
故选D.
B.二氧化碳能与碳酸钠反应生成碳酸氢钠,将原物质除掉,故B错误;
C.二氧化碳和酸都与NaOH溶液反应,将原物质除掉,故C错误;
D.CO2气体混有HCl杂质,可选饱和NaHCO3溶液为除杂试剂,然后用浓硫酸洗气干燥,故D正确.
故选D.
点评:本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
下列叙述正确的是( )
| A、石油裂化主要得到乙烯 |
| B、石油分馏是化学变化,可得到汽油、煤油等 |
| C、煤的干馏主要得到煤焦油、焦炉气、焦炭、粗氨水 |
| D、煤的气化和液化是物理变化,是使煤变成清洁能源的有效途径 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法正确的是( )
| A、1.0L1mol/L氨水中,NH3?H2O的分子数为6.02×1023 |
| B、白磷分子(P4)呈正四面体结构,31g 白磷中含有P-P键个数为6×6.02×1023 |
| C、1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| D、20g 重水(2H216O)中含有的中子数为8×6.02×1023 |
下列叙述不正确的是( )
| A、由分子构成的物质其熔点一般较低 |
| B、分子晶体在熔化时,共价键没有被破坏 |
| C、分子晶体中一定存在共价键 |
| D、分子晶体中分子间作用力越大,其化学性质越稳定 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、常温常压下,17g甲基(-14CH3)所含的电子数为10NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.8g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA |
| D、3mol NO2和足量H2O反应,转移NA个电子 |
有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项事实不能说明上述观点的是( )
| A、乙酸分子中羟基上的氢原子较乙醇中羟基上的氢原子更活泼 |
| B、乙烯能发生加成反应,而乙烷不能发生加成反应 |
| C、甲苯的硝化反应较苯更容易 |
| D、苯酚能和氢氧化钠溶液反应,而乙醇不能和氢氧化钠溶液反应 |
如图是A、B两种物质的溶解度曲线,下列叙述错误的是( )


| A、30℃时,向100克水中加入25克A物质,充分溶解后所得溶液是饱和溶液 |
| B、A物质的饱和溶液从30℃降温到10℃,变成不饱和溶液 |
| C、B物质的饱和溶液从30℃降温到20℃,其溶质质量分数减小 |
| D、30℃时,将B物质的不饱和溶液转变为饱和溶液,可以采取恒温蒸发溶剂的方法 |
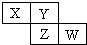 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A、X的气态氢化物比Y的稳定 |
| B、X与Y形成的化合物都易溶于水 |
| C、Z的非金属性比Y的弱 |
| D、原子半径:X>Y>Z>W |



