题目内容
近年来对CO2的有效控制及其高效利用的研究正引起全球广泛关注.据中国化工报报道,美国科学家发现了一种新的可将CO2转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近90倍.由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ?mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ?mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任何温度”).
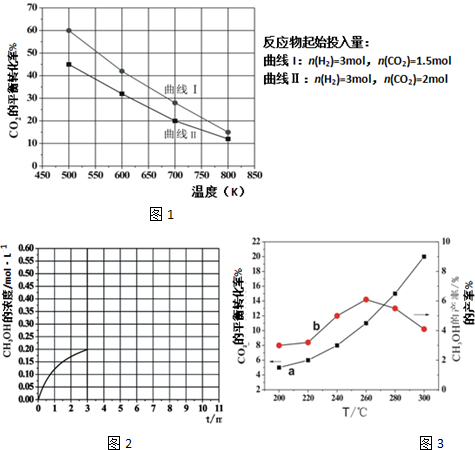
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为
b.该温度下,反应I的平衡常数K=
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是 (选填编号).
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而 (填“增大”、“减小”、“不变”或“无法判断”),其原因是 .

反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ?mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ?mol-1
回答下列问题:
(1)反应Ⅱ的△H2=
(2)在一定条件下2L恒容密闭容器中充入一定量的H2和CO2仅发生反应Ⅰ,实验测得在不同反应物起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示.
①据图可知,若要使CO2的平衡转化率大于40%,以下条件中最合适的是
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.用H2表示该反应的速率为
b.该温度下,反应I的平衡常数K=
c.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图中画出3~10min内容器中CH3OH浓度的变化趋势曲线:
(3)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得了不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图3所示,请回答问题:
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是
A.改用高效催化剂
B.升高温度
C.缩小容器体积
D.分离出甲醇
E.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而
考点:转化率随温度、压强的变化曲线,物质的量或浓度随时间的变化曲线
专题:
分析:(1)根据盖斯定律可以计算化合反应的焓变,根据反应自发行的判据:△H-T△S<0进行回答;
(2)①根据图示CO2的平衡转化率和反应温度的关系来判断回答;
②a.根据速率v=
结合三行式进行计算;
b.化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
c.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
(2)①根据图示CO2的平衡转化率和反应温度的关系来判断回答;
②a.根据速率v=
| △c |
| △t |
b.化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
c.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动的因素都可以;
②根据反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO来回答.
解答:
解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ?mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ?mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ?mol-1)-(-90.77kJ?mol-1)=+41.19 kJ?mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ?mol-1;较低温;
(2)①据图可知,若要使CO2的平衡转化率大于40%,需要n(H2)=3mol,n(CO2)的物质的量大于1.7mol,温度高于550K,故选B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.75 1.5 0 0
变化浓度:0.45 1.35 0.45 0.45
平衡浓度:0.3 0.15 0.45 0.45
a.氢气表示的反应速率=
=0.135 mol?L-1?min-1,故答案为:0.135 mol?L-1?min-1;
b.该温度下,反应I的平衡常数K=
=200,故答案为:200;
c.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为 ,
,
故答案为: ;
;
(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.改用高效催化剂,能加快反应速率,但是不影响平衡的移动,故错误;
B.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
C.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
D.分离出甲醇,不能加快反应速率,故错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大;反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,综上所述,CO的浓度一定增大.
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ?mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ?mol-1)-(-90.77kJ?mol-1)=+41.19 kJ?mol-1;根据反应自发行的判据:△H-T△S<0,反应Ⅲ是熵减的放热的反应,所以要自发进行需要在较低温下进行,
故答案为:+41.19 kJ?mol-1;较低温;
(2)①据图可知,若要使CO2的平衡转化率大于40%,需要n(H2)=3mol,n(CO2)的物质的量大于1.7mol,温度高于550K,故选B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.75 1.5 0 0
变化浓度:0.45 1.35 0.45 0.45
平衡浓度:0.3 0.15 0.45 0.45
a.氢气表示的反应速率=
| 1.35mol/L |
| 10min |
b.该温度下,反应I的平衡常数K=
| 0.45×0.45 |
| 0.3×0.153 |
c.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为
 ,
,故答案为:
 ;
;(3)①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,只要加快反应速率且使得平衡正向移动即可.
A.改用高效催化剂,能加快反应速率,但是不影响平衡的移动,故错误;
B.升高温度,加快反应速率且使得平衡逆向移动,不符合,故错误;
C.缩小容器体积,即增大压强,加快反应速率且使得平衡正向移动,故正确;
D.分离出甲醇,不能加快反应速率,故错误;
E.增加CO2的浓度,可以加快反应速率且使得平衡正向移动,故正确.
故选CE;
②反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,所以当温度高于260℃后,CO的浓度一定增大,
故答案为:增大;反应I、反应III均为放热反应,温度升高不利于CO2、CO转化为甲醇,反应II为吸热反应,温度升高使更多的CO2转化为CO,综上所述,CO的浓度一定增大.
点评:本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.

练习册系列答案
相关题目
下列实验操作不能达到预期目的是( )
A、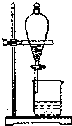 分离CH3COOC2H5和饱和碳酸钠溶液 |
B、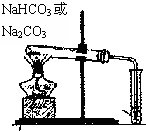 鉴别碳酸钠和碳酸氢钠 |
C、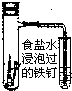 铁的吸氧腐蚀实验 |
D、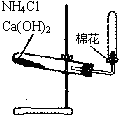 实验室制备氨气 |
人体血液中存在的平衡:H2CO3?H++HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随 变化关系如表所示,则下列说法中错误的是( )
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
有4种碳骨架如下的烃,下列说法正确的是( )

①a和d是同分异构体
②b和c是同系物
③a和d都能发生加聚反应
④只有b和c能发生取代反应.

①a和d是同分异构体
②b和c是同系物
③a和d都能发生加聚反应
④只有b和c能发生取代反应.
| A、①② | B、①④ | C、②③ | D、①②③ |
下列反应所得溶液中只含一种溶质的是( )
| A、Fe2(SO4)3溶液中加入过量Fe粉 |
| B、A1(OH)3中加入过量NaOH溶液 |
| C、浓H2SO4中加入过量Cu片,加热 |
| D、Ca(C1O)2溶液中通入过量CO2 |
常温下,将浓度均为0.1mol/L一元酸HA溶液和NaOH溶液等体积混合,得到混合溶液①,该混合溶液pH=9,下列说法正确的是( )
| A、①溶液中:c(A?)>c(Na+)>c(OH?)>c(H+) |
| B、①溶液中:c(HA)+c(A-)=0.1mol/L |
| C、常温下,0.1mol/LHA溶液的pH=1 |
| D、0.1mol/LHA溶液中:c(HA)>c(A?) |
下列说法正确的是( )
A、化合物 的分子式为C13H9O4N2 的分子式为C13H9O4N2 |
| B、CH3(CH2)2CH3与CH(CH3)3具有不同数目的一氯代物 |
| C、在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
| D、石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
 前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题:
前四周期原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E+核外各能层电子均已充满.请回答下列问题: