题目内容
19.铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下的体积相等时,理论上反应中消耗的H2SO4和NaOH的物质的量之比是( )| A. | 1:1 | B. | 1:2 | C. | 3:2 | D. | 3:1 |
分析 酸、碱均足量,Al完全反应,发生2Al+3H2SO4=2Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,设生成氢气均为3mol,结合反应计算.
解答 解:发生2Al+3H2SO4=2Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
因为足量的稀硫酸和氢氧化钠溶液,Al完全反应,
由反应可知,若均生成3mol气体,消耗Al相同,消耗酸3mol、碱2mol,
则反应中消耗的硫酸和NaOH物质的量之比为3:2,
故选C.
点评 本题考查化学反应方程式的有关计算,为高频考点,把握发生的反应及酸碱足量为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
4.H+、Na+、Ba2+、Al3+、OH-、HCO3-、Cl-七种离子中的两种可以形成甲、乙、丙、丁四种化合物,它们之间可以发生如图转化关系(产物H2O未标出),下列说法不正确的是( )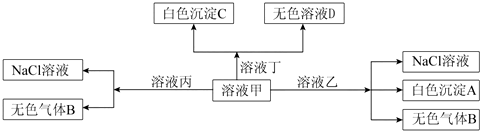

| A. | 溶液乙一定为AlCl3溶液 | |
| B. | 溶液丙与I-、NO3-、SO42-、K+一定可以大量共存 | |
| C. | 在甲中加丁可能发生反应的离子方程式:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| D. | 白色沉淀A可能溶解在溶液D中 |
10.某温度下已知反应mX(g)+nY(g)?qZ(g)△H=+Q kJ•mol-1(Q>0),下列叙述正确的是( )
| A. | 在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
| B. | 反应达到最大限度时,加入X,反应的△H增大 | |
| C. | 反应速率υ正(X)=$\frac{m}{n}$υ正(Y) | |
| D. | 降低温度,反应的速率值变大 |
4.下列各组粒子,质子数和电子数都相等的是( )
| A. | NH4+和OH- | B. | HS-与S2- | C. | CO和N2 | D. | H2O2和K+ |
11.如表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据.
下列说法正确的是( )
| 元素 | I1/eV | I2/eV | I3/eV |
| 甲 | 5.7 | 47.4 | 71.8 |
| 乙 | 7.7 | 15.1 | 80.3 |
| 丙 | 13.0 | 23.9 | 40.0 |
| 丁 | 15.7 | 27.6 | 40.7 |
| A. | 甲的金属性比乙强 | B. | 乙的化合价为+1价 | ||
| C. | 丙一定为非金属元素 | D. | 丁一定是金属元素 |
8.在常温下,将pH=9的NaOH溶液与pH=11的NaOH溶液等体积混合后,溶液的pH最接近于( )
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
9.下列关于有机物的说法正确的是( )
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |