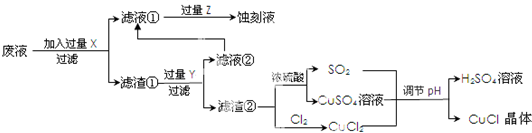
题目内容
粗制的CuSO4?5H2O晶体中含有Fe2+.提纯时,为了除去Fe2+,常加入少量H2O2,然后再滴入少量碱溶液调至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的.则有关操作的原理或说法不符合的是( )
| A、溶解CuSO4?5H2O晶体时要加入少量稀H2SO4 |
| B、加入H2O2,将Fe2+氧化:2Fe2++H2O2+2H+═2Fe3++2H2O |
| C、由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D、调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
考点:铁盐和亚铁盐的相互转变,物质的分离、提纯的基本方法选择与应用
专题:元素及其化合物
分析:为了除去Fe2+,常加入少量H2O2,发生2Fe2++H2O2+2H+═2Fe3++2H2O,生成易水解的Fe3+,在pH=4时,可水解生成Fe(OH)3沉淀而除去,为避免引入新杂质,加入氢氧化铜或碱式碳酸铜可以与H+反应.H+反应后,pH增大,当pH=4的时候,Fe(OH)3完全沉淀,而Cu2+还没沉淀,以Cu2+形式存在,而氢氧化铜或碱式碳酸铜是固体,不会引入新的杂质,据此分析各个选项.
解答:
解:A、为防止铜离子水解生成氢氧化铜沉淀而使溶液浑浊,溶解CuSO4?5H2O晶体时要加入少量稀H2SO4,故A正确;
B、H2O2具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故B正确;
C、H2O2在硫酸铜催化作用下可发生分解反应,故C正确;
D、在pH=4时,Fe3+可水解生成Fe(OH)3沉淀而除去,Cu(OH)2比Fe(OH)3的溶度积大,此时不沉淀,故D错误,故选D.
B、H2O2具有强氧化性,可与Fe2+发生氧化还原反应,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故B正确;
C、H2O2在硫酸铜催化作用下可发生分解反应,故C正确;
D、在pH=4时,Fe3+可水解生成Fe(OH)3沉淀而除去,Cu(OH)2比Fe(OH)3的溶度积大,此时不沉淀,故D错误,故选D.
点评:本题主要考查物质的分离、提纯,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和物质的性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某固体NaOH因吸收了空气中的CO2而含有杂质,若要将该固体配制成较纯的溶液,则其主要的实验操作过程应是( )
| A、溶解→加适量BaCl2溶液→过滤 |
| B、溶解→加适量CaCl2溶液→过滤 |
| C、溶解→加适量Ca(OH)2溶液→过滤 |
| D、溶解→加适量盐酸→加热 |
下列化合物中,不能由金属单质和非金属单质直接化合而得到的是( )
| A、FeCl2 |
| B、CaCl2 |
| C、Fe3O4 |
| D、FeCl3 |
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有( )
| 序号 | X | Y | Z | W | 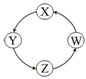 |
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
| A、①②③ | B、①③④ |
| C、②③ | D、①④ |
常温下,0.1mol?L-1的下列溶液中,有关微粒的物质的量浓度关系正确的( )
| A、(NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| D、NaHCO3溶液:c(Na+)+c(H+)+c(H2CO3)=c(OH-)+c(CO32-) |