题目内容
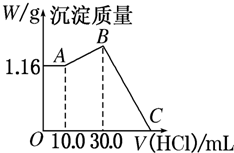 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.(1)A点的沉淀物的化学式为
(2)写出A点至B点发生反应的离子方程式:
(3)原混合物中MgCl2的质量是
考点:镁、铝的重要化合物
专题:
分析:向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,则铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2;
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
B-C过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠.
A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,B点溶液中存在的溶质是氯化钠,沉淀为Mg(OH)2、Al(OH)3;
B-C过程中,氢氧化镁和氢氧化铝都与盐酸反应生成氯化铝和氯化镁,所以C点溶液中的溶质是氯化铝、氯化镁和氯化钠.
解答:
解:(1)向水中固体组成的混合物溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2,故答案:Mg(OH)2;
(2)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,故答案:H2O+AlO2-+H+=Al(OH)3↓;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=
=0.02mol,根据Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol,氯化镁的质量=0.02mol×95g/mol=1.9g;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,氯化铝的质量=0.02mol×133.5g/mol=2.67g;根据铝原子守恒得n(AlCl)=n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol氢氧化钠的质量=0.13mol×40g/mol=5.2g;
故答案为:1.9;2.67;5.2.
(2)A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+AlO2-+H+=Al(OH)3↓,故答案:H2O+AlO2-+H+=Al(OH)3↓;
(3)A点沉淀的是氢氧化镁,则n(Mg(OH)2)=
| 1.16g |
| 58g/mol |
故答案为:1.9;2.67;5.2.
点评:本题考查了镁铝化合物的有关计算,明确曲线变化趋势及每段发生的化学反应是解本题关键,知道各点溶液中对应的溶质是什么,再结合原子守恒来分析解答,易错点是(3),可以从整体上化学式变化来分析,从而得出正确答案,题目难度中等.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
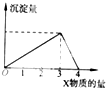 将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为AlCl3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
在强酸性条件下能大量共存的无色透明溶液是( )
| A、Fe3+、K+、Cl-、NO3- |
| B、Ba2+、Cl-、NH4+、HCO3- |
| C、Ag+、Na+、NO3-、Cl- |
| D、Al3+、SO42-、Cl-、Na+ |
下表所列各组物质中,物质之间通过一步反应就能实现如图转化的是( )
| a | b | c |  | |
| A | Al2O3 | AlCl3 | Al(OH)3 | |
| B | CuO | Cu(OH)2 | CuCl2 | |
| C | Si | Na2SiO3 | H2SiO3 | |
| D | CO | NaHCO3 | Na2CO3 |
| A、A | B、B | C、C | D、D |
下列关于Al(OH)3的性质的叙述错误的是( )
| A、Al(OH)3是难溶于水的白色沉淀 |
| B、Al(OH)3能吸附水中的悬浮物 |
| C、Al(OH)3能溶于氨水 |
| D、Al(OH)3属于两性氢氧化物 |
将Xg镁和Yg铝溶于A mL M mol/L的盐酸(过量),再往上述溶液中加入2A mL的NaOH溶液,溶液中的沉淀量达到最大值,则加入NaOH溶液的浓度为( )
| A、M mol?L-1 | ||
| B、2M mol?L-1 | ||
C、
| ||
| D、无法确定 |
常温下a mol?L-1稀氨水和b mol?L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A、若a=b,则c(NH4+)=c(Cl-) |
| B、若a>b,则c(NH4+)>c(Cl-) |
| C、若a>b,则c(OH-)>c(H+) |
| D、若a<b,则c(OH-)<c(H+) |
