题目内容
决定物质性质的重要因素是物质结构.请回答下列问题.
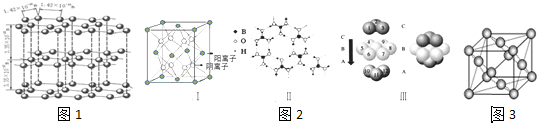
(1)如图1是石墨的结构,其晶体中存在的作用力有 (填序号)
A:σ键 B:π键 C:氢键 D:配位键E:分子间作用力 F:金属键 G:离子键
(2)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
①图2I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为 ,图III中未标号的Cu原子形成晶体后周围最紧邻的Cu原子数为 ;铜在周期表中的位置 ;
②H3BO3晶体中B原子杂化方式 ; CNO-的形状为 ;
(3)如图3是金属铝晶体结构的示意图
已知:铝的相对原子质量为27,金属铝的密度为2.7g?cm-3.求:铝原子的半径r= .(用NA表示阿伏伽德罗常数,列式表示)

(1)如图1是石墨的结构,其晶体中存在的作用力有
A:σ键 B:π键 C:氢键 D:配位键E:分子间作用力 F:金属键 G:离子键
(2)CaF2结构如图Ⅰ所示,Cu形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)
①图2I所示的晶体中与Ca2+离子最近且等距离的Ca2+离子数为
②H3BO3晶体中B原子杂化方式
(3)如图3是金属铝晶体结构的示意图
已知:铝的相对原子质量为27,金属铝的密度为2.7g?cm-3.求:铝原子的半径r=
考点:晶胞的计算
专题:化学键与晶体结构
分析:(1)根据石墨结构判断;
(2)①根据晶胞结构,判断配位数;根据元素对应的原子结构判断元素在周期表中的位置;
②B只形成了3个单键,没有孤电子对,所以采取sp2杂化;CNO-杂化方式为sp2,形状为直线型;
(3)根据m=ρV及变形公式计算.
(2)①根据晶胞结构,判断配位数;根据元素对应的原子结构判断元素在周期表中的位置;
②B只形成了3个单键,没有孤电子对,所以采取sp2杂化;CNO-杂化方式为sp2,形状为直线型;
(3)根据m=ρV及变形公式计算.
解答:
解:(1)石墨为层状结构,杂化类型为sp2,每一片层内部碳原子以σ键结合,每个碳原子还有一个未杂化的p轨道,肩并肩重叠,形成大π键,片层之间以分子间作用力结合,
故答案为:ABE;
(2)①在每个晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个;
图III可看出在每个Cu原子周围有12个Cu原子,Cu原子形成晶体后周围最紧邻的Cu原子数为12;
Cu基态原子电子排布式1s22s22p63s23p63d104s1,可以看出铜在周期表中的位置为第四周期第一副族;
故答案为:12;12;第四周期第一副族;
②B只形成了3个单键,没有孤电子对,所以采取sp2杂化;CNO-的中心原子O电子对数=2+
=2,故杂化方式为sp2,故CNO-的形状为直线型;
故答案为:sp2;直线型;
(3)1mol晶胞中Al原子数=8×
+6×
=2,根据m=ρV=2.7g?cm-3×
πr3NA=27g,可得r=
cm,故答案为:
cm.
故答案为:ABE;
(2)①在每个晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个;
图III可看出在每个Cu原子周围有12个Cu原子,Cu原子形成晶体后周围最紧邻的Cu原子数为12;
Cu基态原子电子排布式1s22s22p63s23p63d104s1,可以看出铜在周期表中的位置为第四周期第一副族;
故答案为:12;12;第四周期第一副族;
②B只形成了3个单键,没有孤电子对,所以采取sp2杂化;CNO-的中心原子O电子对数=2+
| 6-1-5 |
| 2 |
故答案为:sp2;直线型;
(3)1mol晶胞中Al原子数=8×
| 1 |
| 8 |
| 1 |
| 6 |
| 4 |
| 3 |
| 3 |
| ||
| 3 |
| ||
点评:本题考查分子空间构型、杂化类型的判断、晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何判断分子空间构型以及有关晶体计算等方法.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
据最新报道,科学家最近开发出一种生物活性吸附剂,可以吸附水中大部分的微生物和噬菌体.这种新的吸附剂由成本低廉、利于环保的棉纤维素和主要成分为氢氧化铝的勃姆石制造而成.下列有关说法中不正确的是( )
| A、Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 |
| B、这种吸附剂也能吸附色素 |
| C、向Al2(SO4)3溶液中加入过量的NaOH溶液也能得到Al(OH)3 |
| D、实验室中Al(OH)3可以由可溶性铝盐溶液与足量的氨水反应制得 |
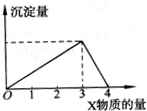 将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加入)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为Al2(SO4)3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
下列有关说法中正确的是( )
| A、烧瓶、锥形瓶、量筒加热时均需垫上石棉网 |
| B、新制氯水保存在棕色细口瓶中,并放在阴凉处 |
| C、将蓝色硫酸铜晶体放入浓硫酸属于物理变化 |
| D、化石燃料属于可再生能源,不影响可持续发展 |
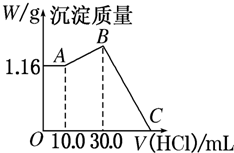 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.