题目内容
将Xg镁和Yg铝溶于A mL M mol/L的盐酸(过量),再往上述溶液中加入2A mL的NaOH溶液,溶液中的沉淀量达到最大值,则加入NaOH溶液的浓度为( )
| A、M mol?L-1 | ||
| B、2M mol?L-1 | ||
C、
| ||
| D、无法确定 |
考点:镁、铝的重要化合物,有关混合物反应的计算
专题:几种重要的金属及其化合物
分析:加入2A mL氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,根据氯元素守恒n(NaCl)=n(HCl),根据n=cV计算n(HCl),由钠元素守恒n(NaCl)=n(NaOH),再根据C=
计算需要氢氧化钠溶液的浓度.
| n |
| V |
解答:
解:加入2A mL的氢氧化钠溶液,并使得沉淀达到最大量,此时溶液中只有氯化钠,
根据氯元素守恒n(NaCl)=n(HCl)=A×10-3L×Mmol?L-1=AM×10-3mol,
由钠元素守恒n(NaOH)=n(NaCl)=AM×10-3mol,
故需要氢氧化钠溶液的浓度为
=
mol/L,
故选C.
根据氯元素守恒n(NaCl)=n(HCl)=A×10-3L×Mmol?L-1=AM×10-3mol,
由钠元素守恒n(NaOH)=n(NaCl)=AM×10-3mol,
故需要氢氧化钠溶液的浓度为
| AM×10 -3mol |
| 2A×10 -3L |
| M |
| 2 |
故选C.
点评:本题考查混合物的有关计算、镁铝的性质,难度不大,注意利用守恒进行计算,判断最后溶液中溶质是氯化钠是关键.

练习册系列答案
相关题目
被称为万能还原剂的NaBH4溶于水并和水发生反应:NaBH4+2H2O=NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( )
| A、NaBH4是氧化剂,H2O是还原剂 |
| B、被氧化的元素与被还原的元素质量比为1:1 |
| C、硼元素被氧化,氢元素被还原 |
| D、NaBH4既是氧化剂又是还原剂 |
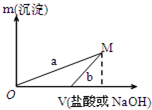 某同学设计了两种方案制备氢氧化铝.
某同学设计了两种方案制备氢氧化铝.方案一:2.7g Al
| 100mL稀盐酸 |
| NaOH溶液 |
方案二:2.7g Al
| 100mLNaOH溶液 |
| 稀盐酸 |
已知所用的稀盐酸与NaOH溶液均为3mol/L.图是向X溶液与Y溶液中分别加入NaOH溶液或稀盐酸时产生沉淀的质量与加入溶液体积之间的关系.相关说法正确的是( )
| A、a曲线表示的是向X溶液中加入NaOH溶液 |
| B、在M点时,两种方案中所得溶液的溶质质量分数相同 |
| C、方案二比方案一生成更多的气体 |
| D、M点以后,a、b两条曲线将重合为一条 |
下列操作或发生事故时的处理方法正确的是( )
| A、浓硫酸不慎沾在皮肤上,应立即用大量水冲洗,再涂上3%~5%的小苏打溶液 |
| B、给试管里的液体加热时,试管应与桌面垂直 |
| C、配制一定物质的量浓度的NaCl溶液时,定容、振荡、摇匀后,发现液面低于刻度线,再加水到刻度线 |
| D、将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 |
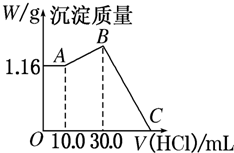 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.