题目内容
常温下a mol?L-1稀氨水和b mol?L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A、若a=b,则c(NH4+)=c(Cl-) |
| B、若a>b,则c(NH4+)>c(Cl-) |
| C、若a>b,则c(OH-)>c(H+) |
| D、若a<b,则c(OH-)<c(H+) |
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.如果a=b,等浓度等体积的氨水和盐酸恰好反应生成氯化铵,根据盐的类型确定离子浓度;
B.如果a>b,等体积混合时,氨水的物质的量大于盐酸,根据溶液中的溶质判断离子浓度;
C.如果a>b,等体积混合时,氨水的物质的量大于盐酸,根据溶液的酸碱性判断;
D.如果a<b,等体积混合时,溶液中的溶质是盐酸和氯化铵,根据溶质判断溶液的酸碱性.
B.如果a>b,等体积混合时,氨水的物质的量大于盐酸,根据溶液中的溶质判断离子浓度;
C.如果a>b,等体积混合时,氨水的物质的量大于盐酸,根据溶液的酸碱性判断;
D.如果a<b,等体积混合时,溶液中的溶质是盐酸和氯化铵,根据溶质判断溶液的酸碱性.
解答:
解:A.如果a=b,等浓度等体积的氨水和盐酸恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性即c(OH-)<c(H+),根据电荷守恒知c(NH4+)<c(Cl-),故A错误;
B.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(NH4+)=c(Cl-),当溶液呈碱性时,c(NH4+)>c(Cl-),故B错误;
C.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(OH-)=c(H+),当溶液呈碱性时,c(OH-)>c(H+),故C错误;
D.如果a<b,等体积混合时,溶液中的溶质是盐酸和氯化铵,溶液呈酸性,则c(OH-)<c(H+),故D正确;
故选D.
B.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(NH4+)=c(Cl-),当溶液呈碱性时,c(NH4+)>c(Cl-),故B错误;
C.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(OH-)=c(H+),当溶液呈碱性时,c(OH-)>c(H+),故C错误;
D.如果a<b,等体积混合时,溶液中的溶质是盐酸和氯化铵,溶液呈酸性,则c(OH-)<c(H+),故D正确;
故选D.
点评:本题考查酸碱混合溶液定性判断,根据溶液中的溶质判断溶液的酸碱性,结合电荷守恒得出离子浓度大小,难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列有关说法中正确的是( )
| A、烧瓶、锥形瓶、量筒加热时均需垫上石棉网 |
| B、新制氯水保存在棕色细口瓶中,并放在阴凉处 |
| C、将蓝色硫酸铜晶体放入浓硫酸属于物理变化 |
| D、化石燃料属于可再生能源,不影响可持续发展 |
下列现象或事实可用同一原理解释的是( )
| A、铁分别加入浓硫酸和氢氧化钠溶液中均无明显现象 |
| B、SO2既能使品红褪色也能使酸性高锰酸钾褪色 |
| C、漂白粉溶液和硅酸钠溶液久置空中都变质 |
| D、H2O2溶液中加入MnO2或FeCl3溶液都能增大反应速率 |
下列说法中正确的是( )
| A、0.1mol/L(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、等浓度的弱酸HA溶液和NaOH溶液等体积混合,所得混合液显碱性 |
下列既含有离子键又含有共价键的化合物是( )
| A、HI |
| B、NaOH |
| C、Br2 |
| D、NaCl |
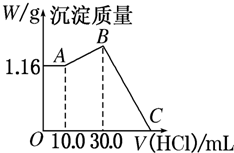 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐滴加入1.00mol?L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.