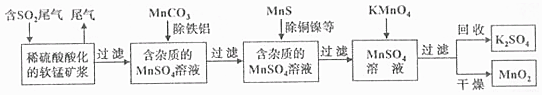
题目内容
8.用NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数为4NA | |
| C. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA | |
| D. | 常温下,2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液所含Fe3+数目不同 |
分析 A.气体摩尔解题使用对象为气体;
B.硫酸钠水溶液中,硫酸钠、水都含有氧原子;
C.气体状况未知;
D.依据盐类水解规律:越弱越水解解答.
解答 解:A.标况下HF为液体,不能使用气体摩尔体积,故A错误;
B.硫酸钠水溶液中,硫酸钠、水都含有氧原子,所以1.0L 1.0mol•L-1Na2SO4水溶液中含有的氧原子数大于4NA,故B错误;
C.气体状况未知,无法计算气体的物质的量和电子转移数目,故C错误;
D.2L0.1mol•L-1FeCl3溶液与1L0.2mol•L-1FeCl3溶液含氯化铁物质的量相同,但是二者浓度不同,三价铁离子水解程度不同,所以二者三价铁离子数目不同,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,主要考查气体摩尔体积的条件应用,氧化还原反应的电子转移计算,质量换算物质的量计算微粒数,解题时注意盐类水解的影响因素,标况下HF 的状态,题目难度不大

练习册系列答案
 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
18.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是( )
| A. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | B. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | ||
| C. | $\frac{84{w}_{2}-53{w}_{1}}{31{w}_{1}}$ | D. | $\frac{115{w}_{2}-84{w}_{1}}{31{w}_{1}}$ |
16.X、Y、Z为短周期元素,电子层数相同,原子序数依次增大,三种元素的最高价氧化物对应的水化物两两之间均可发生反应.下列说法中正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X的最高价氧化物对应的水化物中只含有共价键 | |
| C. | X、Z形成的化合物一定为离子化合物 | |
| D. | 工业上常用Y的氯化物为原料制取单质Y |
3.化学与生活密切相关,下列说法不正确的是( )
| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
13.下列有关说法正确的是( )
| A. | 工业上通常用电解钠、铁、铜对应的氯化物来制备这三种金属的单质 | |
| B. | 陶瓷、玻璃、水泥属于传统无机硅酸盐材料 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了“丹砂”,该过程无氧化还原反应发生 | |
| D. | “青篙一握,以水二升渍,绞取汁”屠呦呦对青蒿素的提取属于化学变化 |
20.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
17.下列做法不符合绿色化学原则的是( )
| A. | 大力开发太阳能,尽量减少化石燃料的使用 | |
| B. | 对废旧电池进行回收利用 | |
| C. | 农作物秸秆露天焚烧以制肥料 | |
| D. | 汽车使用尾气净化装置,减少有害气体排放 |