题目内容
11.短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y的次外层电子数是最外层的$\frac{1}{3}$,ZX是一种生氢剂,W与Y同一主族,下列叙述正确的是( )| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物ZX中各原子均满足8电子稳定结构 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 简单气态氢化物稳定性:W>Y |
分析 X在元素周期表中原子半径最小,应为H元素,Y的次外层电子数是最外层的$\frac{1}{3}$,则最外层电子数为6,应为O元素,ZX是一种生氢剂,应为NaH,Z为Na元素,W与Y同一主族,则W为S元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为H、Y为O、Z为Na、W为S元素.
A.同周期元素从左到右原子半径逐渐减小,应为rZ>rW>rY,故A错误;
B.化合物NaH中H的最外层电子数为2,故B错误;
C.如为NaHSO4,则溶液呈酸性,故C正确;
D.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故D错误.
故选C.
点评 本题考查原子结构和元素周期律,为高频考点,涉及元素推断、元素周期律、物质性质等知识点,把握原子结构、物质性质是解本题关键,易错选项是B,注意NaH的性质.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
1.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上.某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):
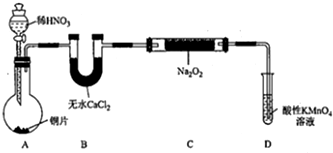
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
b.分别称量0.10g制得的样品溶于水配成500mL溶液.取5mL待测液,加入1mL M溶液,再加蒸馏水至10mL振荡,与标准色阶比较.
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2═2NaNO3
设计制备装置如下(夹持装置略去):

(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O.
(2)如果没有B装置,C中发生的副反应有2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=2NO2.
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质.于是在A、B装置增加了在A、B之间增加装有水的洗气瓶装置,改进后提高了NaNO2的纯度.
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL并振荡,制成标准色阶:
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
(4)步骤b中比较结果是:待测液颜色与③号色阶相同,则甲同学制得的样品中NaNO2的质量分数是40%.
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量.设计并完成下列实验报告.
| 实验方案 | 实验现象 | 实验结论 |
| 取5ml待测液加入维生素C,振荡,再加入1mlM溶液,加入至蒸馏水10mL,再振荡,与③好色阶对比 | 紫红色比③色阶浅 | 维生素C可以有效降低NaNO2的含量 |
2.下列依据相关实验得出的结论,正确的是( )
| A. | 用干净的铂丝蘸取少量溶液在酒精灯外焰上灼烧,发现火焰呈黄色,则溶液中无K+ | |
| B. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| C. | 向某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液X中滴加盐酸无明显现象,再滴加BaCl2溶液有白色沉淀,则X中含有SO42- |
6.常温常压下,改变下列条件,能使饱和硫化氢溶液中$\frac{c({H}^{+})}{c({S}^{2-})}$增大的是( )
| A. | 通入少量NH3 | B. | 加入少量硫化钠 | C. | 通入少量Cl2 | D. | 通入少量H2S |
16.X、Y、Z为短周期元素,电子层数相同,原子序数依次增大,三种元素的最高价氧化物对应的水化物两两之间均可发生反应.下列说法中正确的是( )
| A. | 原子半径:Z>Y>X | |
| B. | X的最高价氧化物对应的水化物中只含有共价键 | |
| C. | X、Z形成的化合物一定为离子化合物 | |
| D. | 工业上常用Y的氯化物为原料制取单质Y |
3.化学与生活密切相关,下列说法不正确的是( )
| A. | 次氯酸钠溶液可用作环境的杀菌消毒 | |
| B. | 硅胶可用作商品包装袋的干燥剂 | |
| C. | 爆竹燃放后,硫燃烧生成SO3 | |
| D. | 施肥时,草木灰不能与胺态氮肥混合使用 |
20.下列说法正确的是( )
| A. | 乙烯使溴水或酸性高锰酸钾溶液褪色均属于加成反应 | |
| B. | CH3CH2CH3分子中的3个碳原子不可能在同一直线上 | |
| C. | 聚氯乙烯、麦芽糖和蛋白质均属于有机高分子化合物 | |
| D. | 等质量的乙烯和乙醇完全燃烧,消耗O2的物质的量相同 |
