题目内容
20.烧杯中盛有含Mg2+、Al3+、Fe3+、Na+、Fe2+、Cl-六种离子的溶液,若向其中加入足量的Na2O2搅拌,充分反应后再向该烧杯中滴加足量的稀盐酸,此时上述离子物质的量保持不变的有( )| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4种 |
分析 Na2O2可与水反应生成NaOH,且具有强氧化性,具有还原性的离子或与OH-反应的离子不能大量共存,再通入过量稀盐酸,可与碱、偏铝酸钠等反应,以此来解答.
解答 解:加入足量Na2O2,Na2O2具有强氧化性且和水反应生成NaOH,Fe2+被氧化生成Fe3+,Al3+→AlO2-,Fe3+→Fe(OH)3,Mg2+→Mg(OH)2,加入盐酸后,Mg(OH)2、AlO2-和Fe(OH)3分别又生成Mg2+、Al3+、Fe3+,则溶液中Fe3+增多,引入钠离子、氯离子,则Na+、Cl-也增多,Fe2+减小,只有Mg2+、Al3+不变,
故选B.
点评 本题考查离子反应及离子共存,为高频考点,把握过氧化钠性质及整个过程中发生的反应是解本题关键,注意过氧化钠的强氧化性,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
11.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种.向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀.则下列结论正确的是( )
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子:${\;}_{\;}^{18}$O | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CH4分子的比例模型: | |
| D. | 乙炔分子的电子式: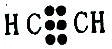 |
15.关于Na2O和Na2O2的叙述正确的是( )
| A. | 都是白色的固体 | B. | 都能和水反应形成强碱溶液 | ||
| C. | 都是碱性氧化物 | D. | 焰色反应的颜色都是紫色 |
5.某有机物的分子式为C8H8,经研究表明该有机物不能发生加成反应和加聚反应.在常温下难于被酸性KMnO4溶液氧化.但在一定条件下却可与Cl2发生取代反应.而且其一氯代物只有一种.下列对该有机物结构的推断中一定正确的是( )
| A. | 该有机物中含有碳碳双键 | B. | 该有机物属于芳香烃 | ||
| C. | 该有机物分子具有平面环状结构 | D. | 该有机物具有三维空间的立体结构 |
12.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | NH3气体(H2O):通过浓H2SO4干燥 | |
| B. | FeCl2溶液(FeCl3):加入铁粉,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |
9.用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 | 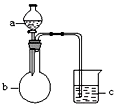 |
| B | 浓盐酸 | MnO2 | 石蕊 试液 | 石蕊试液先 变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH 溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
10.在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | C和D物质的量浓度相等 | ||
| C. | 混合气体的密度 | D. | 混合气体的总物质的量 |
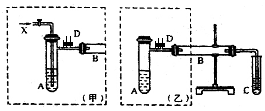 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答: