题目内容
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )| A. | 原子核内有10个中子的氧原子:${\;}_{\;}^{18}$O | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | CH4分子的比例模型: | |
| D. | 乙炔分子的电子式: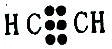 |
分析 A.氧原子质子数为8,质量数=质子数+中子数;
B.乙烯含有碳碳双键官能团;
C.比例模型是依据原子的直径大小紧密堆积在一起的模型;
D.乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对.
解答 解:A.氧原子质子数为8,中子数为10,则质量数为18,原子符号为18O,故A正确;
B.官能团需要写出,乙烯的结构简式:CH2=CH2 ,故B错误;
C. 为甲烷的球棍模型,不是比例模型,故C错误;
为甲烷的球棍模型,不是比例模型,故C错误;
D.乙炔的结构式为H-C≡C-H,C、H之间形成1对共用电子对,C、C之间形成3对共用电子对,其电子式 ,故D错误;
,故D错误;
故选A.
点评 本题考查化学用语,为高频考点,把握分子的结构、电子式的书写为解答的关键,侧重分析与应用算能力的考查,注意乙炔中C与C之间的电子、官能团、原子符号、比例模型和球棍模型的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和金刚石的气化 | D. | 纯碱和烧碱的熔化 |
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下11.2 L乙烯气体含有的分子数为0.5NA | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 1 mol-OH(羟基)中含有10 NA个电子 | |
| D. | 16gCH3OH分子中含有的共价键数目为2.5NA个 |
16.下列事实不能用平衡移动原理解释的是( )
| A. | 蒸干AlCl3溶液,无法得到无水AlCl3 | |
| B. | 用稀H2SO4洗涤BaSO4沉淀,可减少沉淀损失量 | |
| C. | 氯水中加入少量CaCO3粉末,可以提高漂白能力 | |
| D. | 滴加CuSO4溶液可以加快Zn与稀H2SO4反应的速率 |
13.现有NaCl、FeC12、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可以鉴别它们,这种试剂是( )
| A. | 盐酸 | B. | NaOH溶液 | C. | 氨水 | D. | KSCN溶液 |
20.烧杯中盛有含Mg2+、Al3+、Fe3+、Na+、Fe2+、Cl-六种离子的溶液,若向其中加入足量的Na2O2搅拌,充分反应后再向该烧杯中滴加足量的稀盐酸,此时上述离子物质的量保持不变的有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4种 |
17.-定温度下,反应CO(g)+2H2(g)?CH3OH(g)在一个体积可变的密闭容器中达到平衡.充入一定量H2并增大容器体积,维持容器的温度和H2的浓度不变,则达到新平衡时CO的 转化率跟原平衡相比( )
| A. | 增大 | B. | 不变 | C. | 减小 | D. | 无法判断 |
18.下列关于电解质的有关叙述中正确的是( )
| A. | 电解质溶液的浓度越大,其导电性一定越强 | |
| B. | 熔融态能导电的物质一定是离子化合物 | |
| C. | 强极性键的共价化合物不一定都是强电解质 | |
| D. | 多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 |