题目内容
9.用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 | 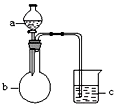 |
| B | 浓盐酸 | MnO2 | 石蕊 试液 | 石蕊试液先 变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH 溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.盐酸易挥发,盐酸与硅酸钠反应生成硅酸;
B.浓盐酸与二氧化锰反应需要加热;
C.Zn与稀硫酸反应生成硫酸锌和氢气,且放热;
D.Al与NaOH溶液反应生成偏铝酸钠和氢气.
解答 解:A.盐酸易挥发,盐酸与硅酸钠反应生成硅酸,则不能比较碳酸、硅酸的酸性,故A错误;
B.浓盐酸与二氧化锰反应需要加热,则不能生成氯气,故B错误;
C.Zn与稀硫酸反应生成硫酸锌和氢气,且放热,开始可能出现的气泡为装置中的空气,故C错误;
D.Al与NaOH溶液反应生成偏铝酸钠和氢气,则产生大量气泡,说明发生了反应,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下11.2 L乙烯气体含有的分子数为0.5NA | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 1 mol-OH(羟基)中含有10 NA个电子 | |
| D. | 16gCH3OH分子中含有的共价键数目为2.5NA个 |
20.烧杯中盛有含Mg2+、Al3+、Fe3+、Na+、Fe2+、Cl-六种离子的溶液,若向其中加入足量的Na2O2搅拌,充分反应后再向该烧杯中滴加足量的稀盐酸,此时上述离子物质的量保持不变的有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 4种 |
17.-定温度下,反应CO(g)+2H2(g)?CH3OH(g)在一个体积可变的密闭容器中达到平衡.充入一定量H2并增大容器体积,维持容器的温度和H2的浓度不变,则达到新平衡时CO的 转化率跟原平衡相比( )
| A. | 增大 | B. | 不变 | C. | 减小 | D. | 无法判断 |
4.除去下列物质中所含的杂质.选用的试剂正确的是( )
| 选项 | 物质(杂质) | 试剂 |
| A | Al2O3(SiO2) | 过量NaOH溶液 |
| B | CO2(HCl) | 饱和Na2CO3溶液 |
| C | Na2O2(Na2O) | O2/加热 |
| D | Al2O3(Fe2O3) | Al粉/加热 |
| A. | A | B. | B | C. | C | D. | D |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1 NaHCO3溶液:K+、Fe3+、Cl-、NO3- | |
| B. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Na+ | |
| C. | 常温下由水电离出的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、Na+、SO32-、NO3- | |
| D. | 常温下在c(H+)=1×10-13mol•L-1的溶液中:Na+、K+、SO42-、CO32- |
1.一定条件下,在密闭恒容的容器中,发生如下反应:3A(g)+2B(g)+6C(g)$\frac{\underline{\;高温\;}}{\;}$M(s)+12N (g),不能表示上述反应达到化学平衡状态的是( )
| A. | 3v逆(B)=v正(C) | B. | 容器内压强不再改变 | ||
| C. | 混合气体密度保持不变 | D. | c(B):c(C):c(N)=1:3:6 |
18.下列关于电解质的有关叙述中正确的是( )
| A. | 电解质溶液的浓度越大,其导电性一定越强 | |
| B. | 熔融态能导电的物质一定是离子化合物 | |
| C. | 强极性键的共价化合物不一定都是强电解质 | |
| D. | 多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强 |