题目内容
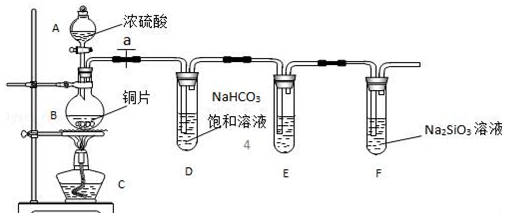
10. 实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙二醇、铜或铜的化合物制备乙二醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:(1)两套装置中的A、B处都需加热,A处用水浴加热,主要优点是试管受热均匀;产生的气流平稳均匀.
(2)若按甲装置进行实验,B管处装铜粉,则通入A管的X是空气(或氧气),B中反应的化学方程式为CH2OHCH2OH+O2$→_{△}^{Cu}$OCH-CHO+2H2O.
(3)若按乙装置进行实验,则B管中应装氧化铜,B中反应的化学方程式为CH2OHCH2OH+2CuO$\stackrel{△}{→}$2Cu+OCH-CHO+2H2O.
(4)实验结束后,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,写出该过程的化学方程式OCH-CHO+4Ag(NH3)2OH$\stackrel{△}{→}$H4NOOC-COONH4+4Ag↓+6NH3+2H2O.
(5)实验完成时先打开D处的活塞,再撤去酒精灯,试说明这样做的目的是防止倒吸.
分析 (1)水浴加热优点:受热均匀,可以得到平稳的乙二醇蒸汽;
(2)按甲装置进行实验,B管处装铜粉,则通入A管的X气体为空气或氧气,目的是为了生成氧化铜催化氧化乙二醇生成乙二醛;
(3)按乙装置进行实验无空气或氧气通入,而氧化铜在加热条件下能够氧化乙二醇生成乙二醛;
(4)根据醛基和银氨溶液反应生成单质银、羧酸铵,氨气和水,依据醛基氧化实质写出化学方程式;
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,可以防止装置内压强降低引起的倒吸.
解答 解:(1)用水浴加热,试管内的液体受热均匀,产生的气流平稳均匀;
故答案为:试管受热均匀;产生的气流平稳均匀;
(2)按甲装置进行实验,B管处装铜粉,则通入A管的X气体为空气或氧气,目的是为了生成氧化铜催化氧化乙二醇,反应的化学方程式为CH2OHCH2OH+O2$→_{△}^{Cu}$OCH-CHO+2H2O;
故答案为:空气(或氧气);CH2OHCH2OH+O2$→_{△}^{Cu}$OCH-CHO+2H2O;
(3)按乙装置进行实验无空气或氧气通入,根据醇催化氧化的实质是被氧化铜氧化得到醛,所以B管中应装入氧化铜,加热条件下反应生成乙二醛,反应的化学方程式为:CH2OHCH2OH+2CuO$\stackrel{△}{→}$2Cu+OCH-CHO+2H2O;
故答案为:氧化铜;CH2OHCH2OH+2CuO$\stackrel{△}{→}$2Cu+OCH-CHO+2H2O;
(4)实验结束后,生成的乙二醛易溶于水,取C试管中的溶液滴入新制备的银氨溶液中并采用水浴加热可观察到有银镜生成,反应的化学方程式为:OCH-CHO+4Ag(NH3)2OH$\stackrel{△}{→}$H4NOOC-COONH4+4Ag↓+6NH3+2H2O;
故答案为:OCH-CHO+4Ag(NH3)2OH$\stackrel{△}{→}$H4NOOC-COONH4+4Ag↓+6NH3+2H2O;
(5)实验完成时先打开D处的铁夹,再撤去酒精灯,可以防止装置内压强降低引起的倒吸;
故答案为:防止倒吸.
点评 本题以乙二醛的制备为载体,考查醇催化氧化反应本质、醛的性质、对装置的理解与评价等,理解醇氧化为醛的反应实质是解题关键,是对基础知识与学生总能力的考查,题目难度中等.

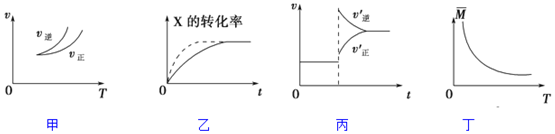
| A. | 依据图甲可判断正反应为吸热反应 | |
| B. | 在图乙中,虚线可表示压强增大 | |
| C. | 若正反应的△H<0,图丙可表示升高温度使平衡向逆反应方向移动 | |
| D. | 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的△H>0 |
| A. | 硝酸和氢氧化钠 | B. | 盐酸和氢氧化镁 | C. | 醋酸和氢氧化钾 | D. | 硫酸和氢氧化钡 |
| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和金刚石的气化 | D. | 纯碱和烧碱的熔化 |

已知:甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;
苯甲酸的熔点为122.4℃,在25℃和95℃下在水中溶解度分别为0.344g和6.8g.
Ⅰ.【制备产品】将30.0mL甲苯和25.0mL 1mol/L高锰酸钾溶液在100℃下反应30min,装置如图1所示.

(1)仪器A的名称为冷凝管,A的进水口为a(填“a”或“b”).支管的作用是平衡压强,使甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.250mL D.500mL
Ⅱ.【分离产品】该同学设计如图2流程分离粗产品苯甲酸和回收甲苯.

(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
Ⅲ.【纯度测定】称取1.220g白色固体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)从白色固体B中得到纯净的苯甲酸的实验方法是:重结晶.
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) | |
| D. | 对于反应N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
| A. | 常温常压下11.2 L乙烯气体含有的分子数为0.5NA | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 1 mol-OH(羟基)中含有10 NA个电子 | |
| D. | 16gCH3OH分子中含有的共价键数目为2.5NA个 |