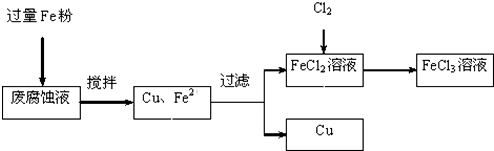
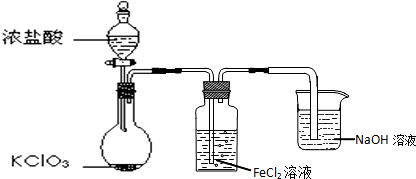
题目内容
2.现有下列基本粒子:1H、2H、3H、1H+、234U、235U、238U、40K、48Ca、Cl2、14N、14C.请回答下列问题:(1)它们分属7种元素,属于氢元素的核素有3种,属于铀元素的核素有3种.质量数相等的粒子为1H、1H+、14N、14C、.
(2)已知元素R的某种核素的氯化物RClx中Rx+离子的核外电子数为z,核内中子数为y,则该核素的组成符号为Y+X+ZZ+XR
(3)在H3O+中,质子数、中子数、电子数之比为11:8:10;在NH3D+中质子数、中子数、电子数之比为10:11:8.
分析 (1)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称;核素是指具有一定数目质子和一定数目中子的一种原子;原子符号左上角的数字为质量数;
(2)根据原子符号的含义以及阳离子中质子数=核外电子数-电荷数,质量数=质子数+中子数;
(3)先计算该微粒中的电子数、质子数、中子数,然后比较.
解答 解:(1)元素的种类由质子数决定,质子数不同,元素的种类就不同,1H、2H、3H、1H+;234U、235U、238U;40K;40Ca;Cl2;14N;14C分别属于H、U、K、Ca、Cl、N、C等7种元素;1H、2H、3H是氢元素的三种核素,即氢元素的核素有3种;234U、235U、238U等属于釉元素,即釉元素的核素有3种;1H、1H+的质量数均为1,14N、14C的质量数均为14,即质量数相等的为1H、1H+,14N、14C.故答案为:7;3;3;1H、1H+,14N、14C;
(2)化合物中R元素的微粒的电子数为Z+X,故质子数=Z+X,质量数=质子数+中子数=Z+X+Y,所以该同位素的符号是Y+X+ZZ+XR,故答案为:Y+X+ZZ+XR;
(3)在H3O+中,质子数、中子数、电子数分别为11、8、10,故个数之比为:11:8:10;在NH3D+中电子数为:7+3×1+1-1=10,质子数为7+3×1+1=11;
H没有中子,所以该微粒的中子数为7+3×0+1=8,所以其比为10:11:8.
故答案为:11:8:10;10:11:8.
点评 注意微粒中核内质子数、核外电子数、所带电荷数的关系:1、阳离子的核内质子数=其核外电子数+所带电荷数;2、阴离子的核内质子数=其核外电子数-所带电荷数.

练习册系列答案
相关题目
12.向NaBr、NaI、Na2SO3混合溶液中通入过量的氯气后,将溶液蒸干并充分灼烧,得到的固体物质为( )
| A. | NaCl Na2SO4 | B. | NaCl NaBr Na2SO4 | ||
| C. | NaCl Na2SO4 I2 | D. | NaCl NaI Na2SO4 |
13.用一种试剂鉴别1-己烯、碘化钾溶液、苯、四氯化碳四种液体,应选用( )
| A. | 盐酸 | B. | FeCl3溶液 | C. | 水 | D. | 溴水 |
17.某学习小组按如下实验流程测定摩尔盐样品的组成.
实验一:称取3.9200g摩尔盐样品配制250mL溶液.
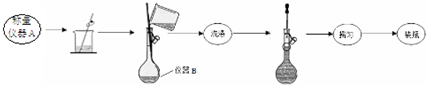
实验二:测定摩尔盐样品组成的方案如下:
①取少量配制液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
②另取少量配制液,加入KSCN溶液,无明显现象.
③定量测定实验如下:
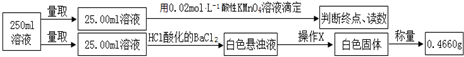
滴定实验结果记录如下:
请回答问题
(1)实验一中仪器名称:仪器A电子天平、仪器B250mL容量瓶.
(2)写出实验一中摇匀的实验操作把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀.
(3)实验二③中操作X为过滤、洗涤、干燥或烘干(冷却)((按操作顺序填写).
(4)实验二③中滴定时发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滴定终点的现象是最后一滴溶液滴入,溶液出现浅紫红色,30秒不褪色.
(5)通过上述实验能否确定摩尔盐样品的组成能(填“能”、“不能”),若能
请写出化学式,若不能请说明理由(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
实验一:称取3.9200g摩尔盐样品配制250mL溶液.

实验二:测定摩尔盐样品组成的方案如下:
①取少量配制液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀.
②另取少量配制液,加入KSCN溶液,无明显现象.
③定量测定实验如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)实验一中仪器名称:仪器A电子天平、仪器B250mL容量瓶.
(2)写出实验一中摇匀的实验操作把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀.
(3)实验二③中操作X为过滤、洗涤、干燥或烘干(冷却)((按操作顺序填写).
(4)实验二③中滴定时发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,滴定终点的现象是最后一滴溶液滴入,溶液出现浅紫红色,30秒不褪色.
(5)通过上述实验能否确定摩尔盐样品的组成能(填“能”、“不能”),若能
请写出化学式,若不能请说明理由(NH4)2SO4•FeSO4•6H2O或(NH4)2Fe(SO4)2•6H2O.
7.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下:
H2(g)+Cl2(g)═2HCl(g)△H1
H2(g)+Br2(g)═2HBr(g)△H2
有关上述反应的叙述正确的是( )
H2(g)+Cl2(g)═2HCl(g)△H1
H2(g)+Br2(g)═2HBr(g)△H2
有关上述反应的叙述正确的是( )
| A. | △H1<△H2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1molHCl气体时放出|△H1|热量 | |
| D. | 1molHBr(g)具有的能量小于1molHBr(l)具有的能量 |
4.分子式为C3H4Cl2的链状有机物有(不考虑立体异构)( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
1.下列有关氧化还原反应的叙述中正确的是( )
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 氧化还原的本质是元素化合价的升降 | |
| C. | 失电子越多,该物质的还原性就越强 | |
| D. | 金属单质在化学反应中一定作还原剂 |