题目内容
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期元素R、T、Q、W、G,根据元素在周期表中的位置知,R属于第二周期,T、Q、W、G属于第三周期,Q是无机非金属材料的主角,则Q是Si元素,T是Al元素、R是N元素、W是S元素、G是Cl元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子半径随着原子序数的增大而减小;
B.S的摩尔质量是32g/mol、氯气的摩尔质量是71g/mol,S、氯气和铁反应方程式分别为S+Fe
FeS、2Fe+3Cl2
2FeCl3,根据方程式计算;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.T和G组成的化合物是AlCl3,溶于水,其水溶液呈酸性.
A.电子层数越多,其离子半径越大,电子层结构相同的离子半径随着原子序数的增大而减小;
B.S的摩尔质量是32g/mol、氯气的摩尔质量是71g/mol,S、氯气和铁反应方程式分别为S+Fe
| ||
| ||
C.元素的非金属性越强,其氢化物的稳定性越强;
D.T和G组成的化合物是AlCl3,溶于水,其水溶液呈酸性.
解答:
解:短周期元素R、T、Q、W、G,根据元素在周期表中的位置知,R属于第二周期,T、Q、W、G属于第三周期,Q是无机非金属材料的主角,则Q是Si元素,T是Al元素、R是N元素、W是S元素、G是Cl元素,
A.电子层数越多,其离子半径越大,电子层结构相同的离子半径随着原子序数的增大而减小,所以离子半径T<G<W,故A错误;
B.S的摩尔质量是32g/mol、氯气的摩尔质量是71g/mol,根据2S+2Fe
2FeS、2Fe+3Cl2
2FeCl3知,消耗相同物质的量的铁,消耗氯气的物质的量大于S,相同质量的S和氯气,氯气的物质的量小于S,所以等物质的量的W、G单质分别与足量铁粉反应,前者消耗的铁粉多,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性R>Q,所以最简单气态氢化物的热稳定性:Q<R,故C正确;
D.T和G组成的化合物是AlCl3,溶于水,AlCl3中铝离子水解导致其水溶液呈酸性,故D错误;
故选C.
A.电子层数越多,其离子半径越大,电子层结构相同的离子半径随着原子序数的增大而减小,所以离子半径T<G<W,故A错误;
B.S的摩尔质量是32g/mol、氯气的摩尔质量是71g/mol,根据2S+2Fe
| ||
| ||
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性R>Q,所以最简单气态氢化物的热稳定性:Q<R,故C正确;
D.T和G组成的化合物是AlCl3,溶于水,AlCl3中铝离子水解导致其水溶液呈酸性,故D错误;
故选C.
点评:本题考查了元素周期表和元素周期律,根据元素在周期表中的位置确定元素,再结合元素周期律、物质的性质、方程式等知识点分析解答,灵活运用元素周期律解答问题,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
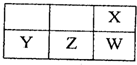 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )| A、X、Z、W的简单氢化物的稳定性Z>W>X |
| B、W元素的单质在化学反应中只表现还原性 |
| C、X、Y的简单离子半径Y>X |
| D、Y、Z、W的最高价氧化物均能与NaOH溶液反应 |
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )


| A、发生电化学腐蚀,铜为负极,铜极产生H2 |
| B、铜易被腐蚀,铜极上发生还原反应,吸收O2 |
| C、铁易被腐蚀,铁发生氧化反应,Fe-2e→Fe2+ |
| D、发生化学腐蚀:Fe+Cu2+→Cu+Fe2+ |
下列针对甲、乙、丙、丁四种实验及装置的说法,不合理的是( )
A、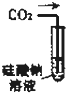 可用来证明碳的非金属性比硅强 |
B、 装置可用于碘水中碘的萃取及分液 |
C、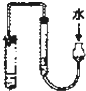 用如图示的方法检查此装置的气密性 |
D、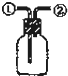 装置:从①进气可收集NO;从②进气可收集NH3 |
下列表达正确的是( )
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |
下列有关化学用语的表述正确的是( )
A、乙烯的球棍模型: |
B、 命名:2-甲基-二丁烯 命名:2-甲基-二丁烯 |
C、过氧化氢的电子式: |
| D、二氧化碳的结构式:O=C=O |
NH3和NO2在催化剂作用下反应:8NH3+6NO2→7N2+12H2O.若还原产物比氧化产物少0.1mol,则下列判断正确的是( )
| A、转移电子4.8NA个 |
| B、生成气体的体积42.56L(标准状况) |
| C、还原剂比氧化剂多0.2mol |
| D、被还原的氮原子是8.4g |