题目内容
铜是一种应用十分广泛的过渡金属.
(1)第四周期过渡元素中,基态原子未成对电子数与铜原子相同的元素是 ,其价电子轨道表示式为 .
(2)二价铜的氧化物熔点比其硫化物 (填“高”或“低”),原因是 .
(3)配合物CuSO4?4NH3?H2O是一种深蓝色晶体,其结构可表示为:
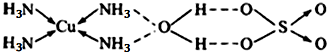
①组成CuSO4?4NH3?H2O的元素中,电负性最大的非金属元素是 .
②CuSO4?4NH3?H2O晶体中,中心原子是sp3杂化的原子有 (写元素符号),其晶体结构中存在的化学键有 .
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力 F.金属键
③将CuSO4?4NH3?H2O溶于水,往溶液中滴入几滴NaOH溶液,未见沉淀生成;若滴入NaOH溶液前先加入少量硫酸,则滴入NaOH溶液时立即生成蓝色沉淀,形成沉淀的原因是 .
(4)PH3是一种无色剧毒气体,其分子结构和NH3相似.下列判断正确的是 .
A.PH3分子呈平面三角形
B.PH3分子是极性分子
C.PH3沸点低于NH3,因为P-H键键能低
D.PH4I属于共价化合物
E.P-H键极性比N-H键极性大.
(1)第四周期过渡元素中,基态原子未成对电子数与铜原子相同的元素是
(2)二价铜的氧化物熔点比其硫化物
(3)配合物CuSO4?4NH3?H2O是一种深蓝色晶体,其结构可表示为:

①组成CuSO4?4NH3?H2O的元素中,电负性最大的非金属元素是
②CuSO4?4NH3?H2O晶体中,中心原子是sp3杂化的原子有
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力 F.金属键
③将CuSO4?4NH3?H2O溶于水,往溶液中滴入几滴NaOH溶液,未见沉淀生成;若滴入NaOH溶液前先加入少量硫酸,则滴入NaOH溶液时立即生成蓝色沉淀,形成沉淀的原因是
(4)PH3是一种无色剧毒气体,其分子结构和NH3相似.下列判断正确的是
A.PH3分子呈平面三角形
B.PH3分子是极性分子
C.PH3沸点低于NH3,因为P-H键键能低
D.PH4I属于共价化合物
E.P-H键极性比N-H键极性大.
考点:配合物的成键情况,原子核外电子排布,化学键,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据Cu的外围电子排布可知Cu有1个未成对电子,结合其它元素的外围电子排布分析;
(2)相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(3)①根据元素的非金属性越强,电负性越强来判断;
②根据分子中中心原子的价层电子对数判断;根据晶体结构中微粒间的作用力分析;
③在溶液中Cu2+与NH3通过配位键结合形成配离子;
(4)根据同主族元素的氢化物的性质相似,结合氨气的结构和性质分析.
(2)相同类型的离子晶体中,晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
(3)①根据元素的非金属性越强,电负性越强来判断;
②根据分子中中心原子的价层电子对数判断;根据晶体结构中微粒间的作用力分析;
③在溶液中Cu2+与NH3通过配位键结合形成配离子;
(4)根据同主族元素的氢化物的性质相似,结合氨气的结构和性质分析.
解答:
解:(1)已知Cu的外围电子排布为3d104s1,可知Cu有1个未成对电子,第四周期过渡元素中,基态原子未成对电子数为1的还有3d14s2,即Sc元素,其价电子轨道表示式为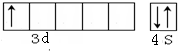 ,
,
故答案为:Sc; ;
;
(2)CuO晶体与CuS都属于离子晶体,O2-半径比S2-小,键能较大,所以CuO晶体的晶格能大于硫化铜,导致CuO晶体的熔点大于硫化铜,
故答案为:高;O2-半径比S2-小,氧化铜的晶格能比硫化铜的大;
(3)①元素的非金属性越强,电负性越强,同周期从左到右非金属性增强,同主族从上到下非金属性减弱,则非金属性最强的为O,即O的电负性最大,
故答案为:O;
②CuSO4中S与O形成4个σ键,没有孤对电子,是sp3杂化,NH3中N与H形成3个σ键,有1对孤对电子,则价层电子对数为4,是sp3杂化,H2O中O与H形成2个σ键,有2对孤对电子,则价层电子对数为4,是sp3杂化,则中心原子是sp3杂化的原子有N、O、S;CuSO4?4NH3?H2O中,Cu与N元素间形成配位键,H与N之间形成共价键,Cu与硫酸根离子之间形成离子键;
故答案为:N、O、S;ABC;
③在溶液中Cu2+与NH3通过配位键结合形成配离子[Cu(NH3)4]2+,[Cu(NH3)4]2+较稳定加NaOH溶液不反应,加硫酸与氨气反应破坏了配位键,再加NaOH溶液与铜离子反应生成氢氧化铜沉淀,
故答案为:在溶液中Cu2+与NH3通过配位键结合形成配离子,加NaOH溶液不反应,加硫酸破坏了配位键;
(4)同主族元素的氢化物的性质相似,则PH3的分子结构和NH3相似,性质NH3与相似;
A.PH3的分子结构和NH3相似,NH3分子为三角锥形,则 PH3的分子为三角锥形,故A错误;
B.三角锥形分子属于极性分子,则PH3分子是极性分子,故B正确;
C.NH3中含有氢键,沸点较高,沸点与共价键无关,故C错误;
D.NH4I属于离子化合物,则PH4I属于离子化合物,故D错误;
E.非金属性越大,则键的极性越大,所以P-H键极性比N-H键极性小,故E错误;
故答案为:B.
 ,
,故答案为:Sc;
 ;
;(2)CuO晶体与CuS都属于离子晶体,O2-半径比S2-小,键能较大,所以CuO晶体的晶格能大于硫化铜,导致CuO晶体的熔点大于硫化铜,
故答案为:高;O2-半径比S2-小,氧化铜的晶格能比硫化铜的大;
(3)①元素的非金属性越强,电负性越强,同周期从左到右非金属性增强,同主族从上到下非金属性减弱,则非金属性最强的为O,即O的电负性最大,
故答案为:O;
②CuSO4中S与O形成4个σ键,没有孤对电子,是sp3杂化,NH3中N与H形成3个σ键,有1对孤对电子,则价层电子对数为4,是sp3杂化,H2O中O与H形成2个σ键,有2对孤对电子,则价层电子对数为4,是sp3杂化,则中心原子是sp3杂化的原子有N、O、S;CuSO4?4NH3?H2O中,Cu与N元素间形成配位键,H与N之间形成共价键,Cu与硫酸根离子之间形成离子键;
故答案为:N、O、S;ABC;
③在溶液中Cu2+与NH3通过配位键结合形成配离子[Cu(NH3)4]2+,[Cu(NH3)4]2+较稳定加NaOH溶液不反应,加硫酸与氨气反应破坏了配位键,再加NaOH溶液与铜离子反应生成氢氧化铜沉淀,
故答案为:在溶液中Cu2+与NH3通过配位键结合形成配离子,加NaOH溶液不反应,加硫酸破坏了配位键;
(4)同主族元素的氢化物的性质相似,则PH3的分子结构和NH3相似,性质NH3与相似;
A.PH3的分子结构和NH3相似,NH3分子为三角锥形,则 PH3的分子为三角锥形,故A错误;
B.三角锥形分子属于极性分子,则PH3分子是极性分子,故B正确;
C.NH3中含有氢键,沸点较高,沸点与共价键无关,故C错误;
D.NH4I属于离子化合物,则PH4I属于离子化合物,故D错误;
E.非金属性越大,则键的极性越大,所以P-H键极性比N-H键极性小,故E错误;
故答案为:B.
点评:本题考查了元素的推断、电子排布式、电负性、配位键、离子晶体熔点的比较等,考查的知识点较多,综合性较强,侧重于考查学生对所学知识的综合应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应中铁元素被还原的是( )
A、2Fe(OH)3
| ||||
| B、Fe+CuSO4=Cu+FeSO4 | ||||
| C、Fe(OH)3+3HCl=FeCl3+3H2O | ||||
D、2Fe2O3+3C
|
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |
分子式为C8H10芳香烃苯环上的一卤代物数目为( )
| A、9种 | B、8种 | C、10种 | D、6种 |
大雾天气可致使高速公路关闭、航班停飞.雾能产生丁达尔效应,雾属于分散系中的( )
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊溶液 |

 氮族元素包括N、P、As、Sb和Bi五种元素.
氮族元素包括N、P、As、Sb和Bi五种元素.