题目内容
下列针对甲、乙、丙、丁四种实验及装置的说法,不合理的是( )
A、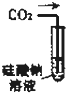 可用来证明碳的非金属性比硅强 |
B、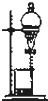 装置可用于碘水中碘的萃取及分液 |
C、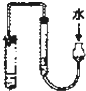 用如图示的方法检查此装置的气密性 |
D、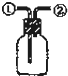 装置:从①进气可收集NO;从②进气可收集NH3 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.根据碘在不同溶剂中的溶解度不同采用萃取的方法分离;
C.能产生压强差的装置能检验装置的气密性;
D.根据气体的溶解性、性质及密度确定气体的收集方法.
B.根据碘在不同溶剂中的溶解度不同采用萃取的方法分离;
C.能产生压强差的装置能检验装置的气密性;
D.根据气体的溶解性、性质及密度确定气体的收集方法.
解答:
解:A.碳酸可以制备硅酸,说明碳酸的酸性强于硅酸,元素的非金属性越强,其最高价氧化物的水化物酸性越强,所以甲可以证明C的非金属性比硅强,故A正确;
B.碘易溶于有机溶剂中,不易溶于水中,且有机溶剂和水不互溶,所以可以通过萃取实现碘与水的分离,故B正确;
C.根据装置特点知,如果两侧的液面高度差不变,则可以说明装置不漏气,故C正确;
D.NO易被氧气氧化生成二氧化氮,所以不能用排空气法收集NO,故D错误;
故选D.
B.碘易溶于有机溶剂中,不易溶于水中,且有机溶剂和水不互溶,所以可以通过萃取实现碘与水的分离,故B正确;
C.根据装置特点知,如果两侧的液面高度差不变,则可以说明装置不漏气,故C正确;
D.NO易被氧气氧化生成二氧化氮,所以不能用排空气法收集NO,故D错误;
故选D.
点评:本题考查了化学实验方案评价,涉及气体的收集、气密性检验、元素非金属性强弱判断等知识点,明确实验原理是解本题关键,根据物质的性质来分析解答即可,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
化学式为CH3Cl的同分异构体数目是( )
| A、1 | B、2 | C、3 | D、4 |
下列反应中铁元素被还原的是( )
A、2Fe(OH)3
| ||||
| B、Fe+CuSO4=Cu+FeSO4 | ||||
| C、Fe(OH)3+3HCl=FeCl3+3H2O | ||||
D、2Fe2O3+3C
|
 如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )
如图为阳离子交换膜法电解饱和食盐水原理示意图.下列说法不正确的是( )| A、从D口逸出的气体是H2 |
| B、从B口加入稀NaOH(增强导电性)的水溶液 |
| C、每生成22.4L Cl2,同时产生2mol NaOH |
| D、从A口加入精制的浓食盐水 |
下列离子方程式书写正确的是( )
| A、澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸和烧碱溶液中和:H++OH-═H2O |
元素X、Y、Z、W的原子序数依次增大,且原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构.下列说法正确的是( )
| A、X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X |
| B、在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等 |
| C、与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 |
| D、X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 |
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |
分子式为C8H10芳香烃苯环上的一卤代物数目为( )
| A、9种 | B、8种 | C、10种 | D、6种 |