题目内容
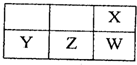 短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,Z的单质是常见的半导体材料.由此可知( )| A、X、Z、W的简单氢化物的稳定性Z>W>X |
| B、W元素的单质在化学反应中只表现还原性 |
| C、X、Y的简单离子半径Y>X |
| D、Y、Z、W的最高价氧化物均能与NaOH溶液反应 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、Z、W,根据元素在周期表中的位置知,X是第二周期元素,Y、Z、W属于第三周期元素,Z的单质是常见的半导体材料,则Z是Si元素,所以Y是Al元素、W是P元素、X是N元素,
A.元素的非金属性越强,其氢化物越稳定;
B.处于中间价态的元素既有氧化性又有还原性;
C.电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
D.酸或两性氢氧化物都能与强碱反应.
A.元素的非金属性越强,其氢化物越稳定;
B.处于中间价态的元素既有氧化性又有还原性;
C.电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
D.酸或两性氢氧化物都能与强碱反应.
解答:
解:短周期元素X、Y、Z、W,根据元素在周期表中的位置知,X是第二周期元素,Y、Z、W属于第三周期元素,Z的单质是常见的半导体材料,则Z是Si元素,所以Y是Al元素、W是P元素、X是N元素,
A.元素的非金属性越强,其氢化物越稳定,非金属性N>P>Si,所以X、Z、W的简单氢化物的稳定性X>W>Z,故A错误;
B.处于中间价态的元素既有氧化性又有还原性,P元素单质的化合价为0价,处于中间价态,所以P既有氧化性又有还原性,故B错误;
C.电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以离子半径Y<X,故C错误;
D.酸性氧化物或两性氧化物都能与强碱反应,Y、Z、W的最高价氧化物分别是Al2O3是两性氧化物,SiO2、P2O5是酸性氧化物,所以都能与NaOH溶液反应生成盐和水,故D正确;
故选D.
A.元素的非金属性越强,其氢化物越稳定,非金属性N>P>Si,所以X、Z、W的简单氢化物的稳定性X>W>Z,故A错误;
B.处于中间价态的元素既有氧化性又有还原性,P元素单质的化合价为0价,处于中间价态,所以P既有氧化性又有还原性,故B错误;
C.电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以离子半径Y<X,故C错误;
D.酸性氧化物或两性氧化物都能与强碱反应,Y、Z、W的最高价氧化物分别是Al2O3是两性氧化物,SiO2、P2O5是酸性氧化物,所以都能与NaOH溶液反应生成盐和水,故D正确;
故选D.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素位置确定元素,再结合元素周期律分析解答,注意氧化铝属于两性氧化物,能和强酸、强碱反应,题目难度不大.

练习册系列答案
相关题目
元素周期表中铋元素的数据见图,下列说法不正确的是( )


| A、Bi元素的质量数是209 |
| B、Bi元素的相对原子质量是209.0 |
| C、Bi元素属于金属元素 |
| D、Bi原子核外有83个电子 |
下列有关卤族元素的说法中,正确的是( )
| A、原子半径:F>Cl>Br>I |
| B、单质的氧化性:I2>Br2>Cl2>F2 |
| C、熔、沸点:F2>Cl2>Br2>I2 |
| D、热稳定性:HF>HCl>HBr>HI |
化学式为CH3Cl的同分异构体数目是( )
| A、1 | B、2 | C、3 | D、4 |
下列说法正确的是( )
| A、1 mol物质的质量就是该物质的摩尔质量 |
| B、1 mol气体的体积就是气体摩尔体积 |
| C、1 mol任何粒子的相应粒子数叫做阿伏加德罗常数 |
| D、1 mol HCl溶于1 L水中,所得盐酸的物质的量浓度为1 mol?L-1 |
 短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的位置如图所示,其中Y所处的周期序数与主族序数之和为8.下列说法错误的是( )| A、Z元素的氧化物对应水化物的酸性一定弱于W |
| B、四种元素中Z的原子半径和形成的离子半径均最大 |
| C、X、Z、W中最简单气态氢化物稳定性最弱的是Z |
| D、X、Y、Z的原子均能与氢原子形成四原子分子 |
某元素X的最高正价与最低负价的代数和为4,则该元素的最高价氧化物的水化物或气态氢化物的化学式正确的是( )
| A、XH4 |
| B、H2XO4 |
| C、H3XO4 |
| D、HX |
下列反应中铁元素被还原的是( )
A、2Fe(OH)3
| ||||
| B、Fe+CuSO4=Cu+FeSO4 | ||||
| C、Fe(OH)3+3HCl=FeCl3+3H2O | ||||
D、2Fe2O3+3C
|
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |