题目内容
1.工业上粗硅的生产原理为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列说法正确的是( )| A. | SiO2是氧化剂 | B. | SiO2发生氧化反应 | ||
| C. | C表现出氧化性 | D. | C被还原 |
分析 在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,据此分析解答.
解答 解:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑中,碳元素化合价由0价变为+2价,硅元素化合价由+4价变为0价,所以碳是还原剂,表现出还原性,被氧化,二氧化硅是氧化剂,发生还原反应,故选A.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,难度不大.

练习册系列答案
相关题目
11.1mol某烃在氧气中充分燃烧,需要消耗氧气8mol.它在光照的条件下与氯气反应,生成三种不同的一氯取代物.该烃的结构简式是( )
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 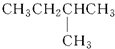 | D. |  |
12.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 3.36 LNO2与水充分反应转移的电子数目为0.1NA | |
| B. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| C. | 50 g质量分数为68%的H2O2的水溶液中含氧原子数为2NA | |
| D. | 常温下,l L0.1 mol•L-1的硝酸铵溶液中氮原子数目小于0.2NA |
9.含镁离子和铝离子个数比为1:2的氯化镁和氯化铝两种溶液,若使溶液中的氯离子完全沉淀,用去相同浓度的硝酸银溶液的质量比为( )
| A. | 1:3 | B. | 1:2 | C. | 3:1 | D. | 3:2 |
13.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2,下列说法中不正确的是( )
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液碱性减弱,正极区溶液碱性增强 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
10.下图所示的实验操作,不能达到实验目的是( )
| A. |  干燥Cl2 | B. |  证明氨气极易溶于水 | ||
| C. |  检验K2CO3中的K+ | D. |  实验室制取氨气 |
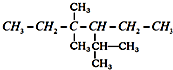 系统命名:2,4,4-三甲基-3-乙基己烷.
系统命名:2,4,4-三甲基-3-乙基己烷. 的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.
的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.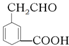 碳碳双键、醛基、羧基.
碳碳双键、醛基、羧基.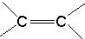 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此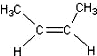 和
和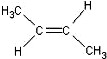 是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )
 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
.