题目内容
20.将硫酸在下列反应中所表现的性质,用编号填在横线上.A.酸性;B.沸点高;C.吸水性;D.脱水性 E.强氧化性.
(1)浓H2SO4敞口放置质量增加:C;
(2)用铁制槽车装运浓H2SO4E;
(3)实验室用稀硫酸制氢气:A;
(4)浓硫酸滴在蓝色石蕊试纸上,先变红后变黑A、D;
(5)铜片在加热条件下能溶解在浓H2SO4中:A、E.
分析 浓硫酸具有吸水性,可用作干燥剂,具有脱水性,可使纸脱水碳化,具有强氧化性,可使铝、铁在常温下钝化,以此解答该题.
解答 解:(1)浓硫酸具有吸水性,敞口久置会增重,故答案为:C;
(2)冷浓H2SO4中放入铝片没有明显现象,金属产生钝化现象,在铝表面生成一层致密的氧化物薄膜,阻止了进一步反应,可铝槽车装运浓硫酸体现浓硫酸的强氧化性,
故答案为:E;
(3)实验室用稀硫酸制氢气,表现硫酸的酸性,故答案为:A;
(4)浓硫酸滴在蓝色石蕊试纸上,先变红后变黑,酸性和氧化性,故答案为:A、D;
(5)浓硫酸和铜在加热条件下反应,体现浓硫酸的酸性和强氧化性,故答案为:A、E.
点评 本题综合考查浓硫酸的性质,为高考常见题型和高频考点,注意浓硫酸的特性,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
10.下图所示的实验操作,不能达到实验目的是( )
| A. |  干燥Cl2 | B. |  证明氨气极易溶于水 | ||
| C. |  检验K2CO3中的K+ | D. |  实验室制取氨气 |
15.常温下,A溶液的PH=6,B溶液的[OH-]=10-10mol/L,C溶液的[H+]=10-1mol/L,三种溶液的酸性由强到弱的顺序是( )
| A. | ABC | B. | CBA | C. | BCA | D. | BAC |
12.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| D. | F2比O2更容易与H2反应 |

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
.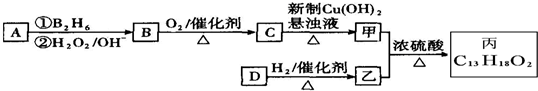
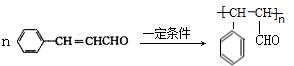 .
. .
. .
. A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图,B的最外层电子数比K层电子多1,D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空: