题目内容
14.1.25g某气体含有分子数目为1.204×1022,则该气体的摩尔质量为62.5g/mol.分析 根据分子个数求出气体的物质的量n=$\frac{N}{{N}_{A}}$,然后根据摩尔质量M=$\frac{m}{n}$来计算,据此分析.
解答 解:气体的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{1.204×1{0}^{22}}{6.02×1{0}^{23}}$=0.02mol,故气体的摩尔质量M=$\frac{m}{n}$=$\frac{1.25g}{0.02mol}$=62.5g/mol,故答案为:62.5g/mol.
点评 本题考查了摩尔质量和物质的量的求算,难度不大,注意公式的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.氢元素有三种核素:1H、2H、3H,氯元素有两种核素:35Cl、37Cl;最多可以组成的氯化氢分子的种类有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
2.下列有关元素周期律的叙述中,正确的是( )
| A. | 酸性强弱:H3PO4<H2SO4 | B. | 金属性强弱:K<Na | ||
| C. | 碱性强弱:NaOH<Mg(OH)2 | D. | 原子半径:Cl>S |
9.NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )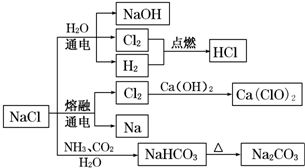

| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | NaHCO3 受热分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | 电解饱和氯化钠溶液的方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| D. | 图中所示转化反应都是氧化还原反应 |
6.最近科学家开发出一种新型的燃料电池-固体氧化物电池,该电池用辛烷(C8H18)作燃料,电池中间部分为固体氧化物陶瓷,可传递氧离子.下列说法中正确的是( )
| A. | 电池工作时,氧气发生氧化反应 | |
| B. | 电池正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池负极的电极反应为:2C8H18+50 O2-═16CO2+18H2O+100 e- | |
| D. | 若消耗的O2为11.2 L (标准状况),则电池中有1 mol电子发生转移 |
3.W、X、Y、Z、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是( )

| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 | |
| D. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 |
4.化学试剂不变质和实验方法科学是化学实验成功的保障.下列试剂保存方法或实验方法中,不正确的是( )
| A. | 实验室中金属钠通常保存在煤油里 | |
| B. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| C. | 保存FeCl3溶液时,通常在溶液中加少量的单质铁 | |
| D. | 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处 |