题目内容
9.NaCl是一种化工原料,可以制备一系列物质(如图所示).下列说法正确的是( )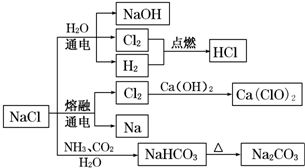
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | NaHCO3 受热分解的方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | 电解饱和氯化钠溶液的方程式为:2NaCl$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | |
| D. | 图中所示转化反应都是氧化还原反应 |
分析 A、根据其阴离子的水解程度判断;
B、碳酸氢钠不稳定受热易分解;
C、电解饱和氯化钠溶液得到氢氧化钠、氢气和氯气,方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑;
D、根据元素的化合价是否变化判断.
解答 解:A、碳酸根的第一步水解(水解后生成碳酸氢根和氢氧根)的平衡常数比碳酸氢根要大许多.碳酸根水解要比碳酸氢根容易得多.所以溶解度较大,且溶解的快,故A错误;
B、碳酸氢钠不稳定受热易分解,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故B正确;
C、电解饱和氯化钠溶液得到氢氧化钠、氢气和氯气,方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑,故C错误;
D、氯化钠和水、氨气、二氧化碳的反应以及碳酸氢钠的分解反应都不是氧化还原反应,故D错误.
故选B.
点评 本题考查了盐的溶解性、氧化还原反应、化学反应等问题,是小型综合题,学生要清楚碳酸钠的溶解度大于碳酸氢钠、碳酸氢钠不稳定受热易分解.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列叙述中正确的是( )
| A. | 氧气的摩尔质量是32 g | |
| B. | 6.02×1023个N2分子的质量是28 g/mol | |
| C. | 1 mol H2O的质量是18g | |
| D. | 1 mol CO2中所含氧原子数约是6.02×1023个 |
15.有一在空气中暴露过久的生石灰,经分析其中含氢氧化钙为a%,含碳酸钙b%,现取一定量的该固体,加入100mL1mol•L-1的盐酸中,为了反应掉过量的酸,需继续往反应后的溶液中加mg的原样品,由此可知蒸发中和后的溶液可得固体质量为( )
| A. | 5.55g | B. | 7.55g | C. | 11.1g | D. | 无 |
17.下列液体均处于 25℃,有关叙述正确的是( )
| A. | 某物质的溶液 pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | Na2CO3溶液加水稀释后,恢复至原温度,pH 和 Kw 均减小 | |
| C. | pH=5.6 的 CH3COOH 与 CH3COONa 混合溶液中,c(Na+)>c(CH3COO-) | |
| D. | pH=4.5 的番茄汁中 c(H+)是 pH=6.5 的牛奶中 c(H +)的 100 倍 |
1.某金属首饰可能含有铜或银,欲检验其是否用纯金制成,可把样品浸入某溶液一段时间后,取出洗净、干燥后称量,根据质量是否变化即可判断.可以选用的溶液是( )
| A. | 稀硫酸 | B. | 盐酸溶液 | C. | 稀硝酸 | D. | 氢氧化钠溶液 |
19.一定条件下某容器中各微粒在反应前后的变化如图所示,其中●和○代表不同元素的原子.关于此反应说法错误的是( )


| A. | 一定属于可逆反应 | B. | 一定属于化合反应 | ||
| C. | 一定属于氧化还原反应 | D. | 一定属于吸热反应 |