题目内容
8.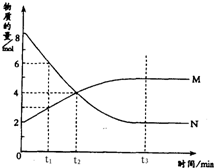 在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N两种气体的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | t1时,N的浓度是M浓度的2倍 | |
| B. | 反应的化学方程式为N?2M | |
| C. | t2时,正逆反应速率相等,达到平衡状态 | |
| D. | t3时,正反应速率小于逆反应速率 |
分析 A.根据某一时刻反应物和生成物的物质的量多少判断浓度的关系;
B.根据图象判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
C.根据各组分的浓度是否不再变化判断平衡状态;
D.根据某一时间反应中各物质的物质的量是否变化判断反应是否达到平衡.
解答 解:A.t1时,N的物质的量为6mol.M的物质的量为3mol,故N的浓度是M浓度的2倍,故A正确;
B.由图象可知,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图象中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为:2N?M,故B错误;
C.由图可知t2时,此时反应继续向正方向移动,正反应速率大于逆反应速率,反应没有达到平衡,故C错误;
D.由图可知t3时,各组分的浓度不再变化,反应达到平衡,正逆反应速率相等,故D错误;
故选A.
点评 本题考查化学反应速率与化学平衡知识,做题时注意从反应物和生成物的物质的量的变化角度,判断反应物和生成物以及反应是否达到平衡,题目难度中等.

练习册系列答案
相关题目
18.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 福尔马林 | B. | 18.4 mol•L-1的硫酸溶液 | ||
| C. | 饱和Na2SO4溶液 | D. | 1 mol•L-1的CuSO4溶液 |
19.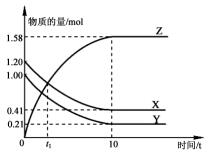 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | t1时,Z和X的浓度相等,达到了化学平衡状态 | |
| C. | 反应开始到10 s时,Y的正逆反应速率都相等 | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
16.丙烯醇(CH2═CH-CH2OH)可发生的化学反应有( )
①加成②氧化③酯化④加聚⑤取代.
①加成②氧化③酯化④加聚⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有①③④ |
3.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )


| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生加成反应而使溴水褪色 | |
| C. | 丙与浓硫酸、浓硝酸的混合液共热发生取代反应 | |
| D. | 丁可与NaHCO3发生取代反应 |
13.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)请完成此实验设计,其中:V1=2.0,V2=3.0.
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
①该小组同学提出的假设是Mn2+对该反应有催化作用.
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| ① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(2)实验①、②探究的是浓度对化学反应速率的影响,根据表中的实验数据,可以得到的结论是其他条件不变时,增大(减小)反应物浓度,加快(减慢)化学反应速率.
(3)探究温度对化学反应速率的影响,应选择②③(填实验编号).
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为1.0×10-2mol/(L•min).
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究.
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加 入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C 2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
②若该小组同学提出的假设成立,应观察到加入MnSO4固体后,KMnO4溶液比实验②更快褪色现象.
20.2011国际化学年主题是“化学-我们的生活,我们的未来”.下列叙述正确的是( )
| A. | 利用太阳能、潮汐能、煤炭发电,以获取清洁能源 | |
| B. | 反应热等于恒压体系中,反应过程产生的焓变 | |
| C. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 |
17. 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
 如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
如图是酸性介质的氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )| A. | a极是负极 | B. | 电解质溶液中的H+向b极移动 | ||
| C. | 电子由b通过灯泡流向a | D. | 氢氧燃料电池是环保电池 |
18.表为六种短周期元素的部分性质,下列有关说法错误的是( )
| 元素代号 | X | Y | Z | Q | R | T |
| 原子半径/10-10m | 0.77 | 0.66 | 0.70 | 1.17 | 0.99 | 1.10 |
| 主要化合价 | +4、-4 | -2 | +5、-3 | +4、-4 | +7、-1 | +5、-3 |
| A. | X与Y可以形成阴离子XY32- | |
| B. | Z的氢化物的沸点比T的氢化物的沸点高 | |
| C. | 元素R的氧化物对应水化物一定为强酸 | |
| D. | 由X形成的化合物QX和XR4,其晶体类型不相同 |