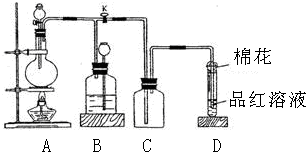
题目内容
1.短周期元素X和元素Y位于不同的周期,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则关于X、Y两元素形成的化合物的说法正确的是( )| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
分析 短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则L层电子数为8,所以a+b=8,所以元素X原子有2个电子层,故b=2,所以a=8-b=8-2=6,故X为O元素;故元素Y原子的M层电子数为a-b=6-2=4,故Y为Si元素,X、Y两元素形成的化合物为SiO2.结合元素化合物的性质判断.
解答 解:短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则L层电子数为8,所以a+b=8,所以元素X原子有2个电子层,故b=2,所以a=8-b=8-2=6,故X为O元素;故元素Y原子的M层电子数为a-b=6-2=4,故Y为Si元素,X、Y两元素形成的化合物为SiO2.
A.SiO2是酸性氧化物,故A错误;
B.SiO2与氢氧化钠反应生成硅酸钠与水,故B正确;
C.SiO2性质稳定,溶于HF酸,不溶于其它酸,与硫酸不反应,故C错误;
D、SiO2不与水反应,难溶于水,故D错误.
故选:B.
点评 本题考查结构位置关系、核外电子排布规律、二氧化硅的性质等,难度不大,根据电子排布规律推断元素是关键,注意二氧化硅性质的特殊性.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
20.反应2SO2(g)+O2(g)═2SO3(g)经一段时间后,SO3的浓度增加了0.4mol•L-1,在这段时间内用O2表示的反应速率为0.04mol•L-1•s-1,则这段时间为C( )
| A. | 0.1s | B. | 2.5s | C. | 5s | D. | 10s |
16.下列反应属于放热反应的是( )
| A. | 氯化铵与八水合氢氧化钡反应 | |
| B. | 碳与水蒸气高温制取水煤气 | |
| C. | 氢氧化钾和硫酸中和 | |
| D. | 碳酸钙高温分解成氧化钙和二氧化碳 |
6.请回答下列问题:
(1)N、Al、Si、Zn、Fe五种元素中,有一种元素的电离能数据如下:
则该元素是Al(填写元素符号).N原子的价电子排布图为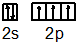 .
.
(2)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为15NA;
(3)K3[Fe(CN)6]可用来检验Fe2+,向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],观察到的现象是产生蓝色沉淀,与CN-互为等电子体的微粒有CO、N2等(填化学式,写2种)
C、N、O三种元素第一电离能由大到小的顺序为N>O>C;三种元素形成的简单氢化物分子中键角由大到小依次为CH4>NH3>H2O(用分子式表示).
(4)已知Fe的相对原子质量为M,阿佛加德罗常数用NA表示,已知金属Fe为体心立方堆积,若Fe原子半径为acm,密度为ρg/cm3.则M=$\frac{32ρ{a}^{3}{N}_{A}}{3\sqrt{3}}$(用ρ、a、NA表达式表示)
(1)N、Al、Si、Zn、Fe五种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | … |
| Im/kJ•mol-1 | 578 | 1817 | 2745 | 11578 | … |
 .
.(2)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为15NA;
(3)K3[Fe(CN)6]可用来检验Fe2+,向硫酸亚铁溶液中加入几滴K3[Fe(CN)6],观察到的现象是产生蓝色沉淀,与CN-互为等电子体的微粒有CO、N2等(填化学式,写2种)
C、N、O三种元素第一电离能由大到小的顺序为N>O>C;三种元素形成的简单氢化物分子中键角由大到小依次为CH4>NH3>H2O(用分子式表示).
(4)已知Fe的相对原子质量为M,阿佛加德罗常数用NA表示,已知金属Fe为体心立方堆积,若Fe原子半径为acm,密度为ρg/cm3.则M=$\frac{32ρ{a}^{3}{N}_{A}}{3\sqrt{3}}$(用ρ、a、NA表达式表示)
10.下列离子方程式书写正确的是( )
| A. | 氯气溶于水:H2O+Cl2═2H++ClOˉ+Clˉ | |
| B. | 锌片插入稀H2SO4溶液中:Zn+2H+═Zn2++H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═H2O+BaSO4↓ | |
| D. | 碳酸钙溶于稀盐酸:CO32-+2H+═H2O+CO2↑ |
11.下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
| A. | 钠在氧气中燃烧 | B. | NaOH溶液滴入NH4HCO3溶液 | ||
| C. | 稀硝酸中加入铁粉 | D. | 镁与H2SO4溶液 |

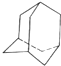 油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示:
油田开采的石油中溶有一种碳氢化合物--金刚烷,它的分子立体结构如图所示: