题目内容
1.乙烯是重要的化工原料,根据所学知识用乙烯制备乙酸乙酯,无机试剂自选.
问题:(1)写出上述过程中②④两步的化学方程式.
(2)分别写出D在酸性条件和碱条件水解的化学方程式.
分析 用乙烯制备乙酸乙酯,应分别制备乙醇和乙酸,由转化关系可知,乙烯和水发生加成反应生成乙醇,则A结构简式为CH3CH2OH,乙醇被氧化生成乙醛,乙醛被氧化生成B为CH3CHO,C为CH3COOH,乙醇和乙酸发生酯化反应生成D为CH3COOCH2CH3,以此解答该题.
解答 解:用乙烯制备乙酸乙酯,应分别制备乙醇和乙酸,由转化关系可知,乙烯和水发生加成反应生成乙醇,则A结构简式为CH3CH2OH,乙醇被氧化生成乙醛,乙醛被氧化生成B为CH3CHO,C为CH3COOH,乙醇和乙酸发生酯化反应生成D为CH3COOCH2CH3,
(1)②为乙醇的催化氧化,反应的方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,④为酯化反应,方程式为CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
答:上述过程中②④两步的化学方程式分别为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)D为CH3COOCH2CH3,在酸性条件下水解生成乙酸和乙醇,方程式为CH3COOC2H5+H2O$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH,
在碱性条件下水解生成乙酸钠和乙醇,方程式为CH3COOC2H5+NaOH→CH3COONa+CH3CH2OH,
答:D在酸性条件和碱条件水解的化学方程式分别为CH3COOC2H5+H2O$→_{△}^{稀硫酸}$CH3COOH+CH3CH2OH,CH3COOC2H5+NaOH→CH3COONa+CH3CH2OH.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,熟练掌握常见有机物官能团及其性质,题目难度不大.

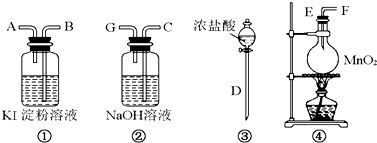
| A. |  除去CO中的CO2 除去CO中的CO2 | B. |  探究二氧化锰对反应速率的影响 探究二氧化锰对反应速率的影响 | ||
| C. |  探究空气中氧气的含量 探究空气中氧气的含量 | D. |  探究溶解性的影响因素 探究溶解性的影响因素 |
①水玻璃 ②水泥 ③普通玻璃 ④漂白粉 ⑤Na2CO3•10H2O ⑥氯水 ⑦液氯 ⑧纯净的盐酸.
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
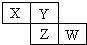 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的L层电子是K层电子数的3倍,下列说法不正确的是( )| A. | Y的气态氢化物比X的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Y的非金属性比Z的强 | |
| D. | X与Y形成的化合物都易溶于水 |
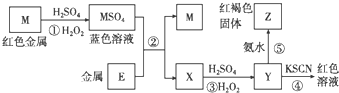
| A. | E2+的氧化性比M2+的氧化性强 | |
| B. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 | |
| C. | 反应④的离子方程式可表示为:E3++3SCN-?E(SCN)3↓ | |
| D. | 在反应①中只能用浓硫酸,既表现了酸性、又表现了氧化性 |
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
(1)将称量好的4.3g烧碱样品配制成250mL待测液,配制过程使用的主要仪器除250mL容量瓶、量筒、烧杯、胶头滴管外,还有一种必须使用的仪器是玻璃棒.
(2)用碱式滴定管量取10.00mL待测液于锥形瓶中,滴入几滴酚酞.
(3)用0.20mol•L-1的标准盐酸滴定待测液,判断滴定终点的现象是:滴入最后一滴盐酸时,锥形瓶内溶液恰好由红色变无色,并且半分钟内不变色.
(4)如果实验操作正确,从滴定开始到结束,溶液中的离子浓度关系可以出现的是B、C(填答案字母序号)
A.c(Na+)>c(Cl-)>c(H+)>c(OH-)
B.c(Na+)>c(OH-)>c(Cl-)>c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(Cl-)
D.c(Na+)+c(H+)>c(OH-)+c(Cl-)
(5)根据下列数据计算,c(NaOH)=0.40mol/L,烧碱的纯度为93%(保留整数)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
A.滴定前平视,滴定后俯视 B.用标准液润洗滴定管
C.用待测液润洗锥形瓶 D.不小心将标准液滴在锥形瓶外面
E.滴定接近终点时,用少量蒸馏水冲洗锥形瓶内.
 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系.