题目内容
3. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
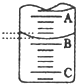
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,
A处的刻度为25,滴定管中液面读数应为25.40mL.,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准漓浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(不必化简):$\frac{\frac{25.28+25.32}{2}×c×0.1×60}{2V}$.
分析 (1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;量取酸应该用酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.1mL,A处的刻度 25,据此确定B的刻度,注意滴定管的上面数值小,下面数值大;
(3)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)利用平均值计算醋酸的质量,再根据酸度公式计算其酸度.
解答 解:(1)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂,故选酚酞;白醋是酸性溶液,应该用酸式滴定管量取;
故答案为:酚酞;酸式滴定管;
(2)A与C刻度间相差1ml,说明每两个小格之间是0.10mL,A处的刻度为25,A和B之间是四个小格,所以相差0.40mL,则B是25.40mL,由于滴定管50.00mL刻度下方还有液体,所以实际溶液的液体大于24.60mL,
故答案为:25.40;大于24.60mL;
(3)从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,上面测得的醋酸浓度偏大,
A.验结束时俯视刻度线读取滴定终点时NaOH溶液的体积,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故A错误;
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故B正确;
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗,标准液被稀释,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故C正确;
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故D错误;
故选BC;
(4)醋酸和氢氧化钠反应的物质的量相等,两次使用氢氧化钠溶液的平均体积=$\frac{25.32+25.28}{2}$mL,则醋酸的质量=
$\frac{25.32+25.28}{2}$mL×10-3$\frac{L}{mL}$×Cmol/L×60g/mol,白醋体积为VmL,所以其酸度=$\frac{\frac{25.32+25.28}{2}×10{\;}^{-3}×c×60}{V}×100$=$\frac{\frac{25.28+25.32}{2}×c×0.1×60}{2V}$
故答案为:$\frac{\frac{25.28+25.32}{2}×c×0.1×60}{2V}$.
点评 本题考查酸碱滴定实验,误差分析,难度较大,会根据实际需要选取指示剂,关于酸度的计算为易错点.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案下列关于金属钠的叙述错误的是( )
A.钠的还原性很强,只能以化合态存在于自然界
B.钠质地柔软,可用小刀切割,保存在煤油中
C.钠失火后可用大量水或泡沫灭火器扑灭
D.钠的焰色反应为黄色,可用在雾天做指示灯
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围 (PH) | 5.0-8.0 | 3.1-4.4 | 4.4-6.2 | 8.2-10.0 |
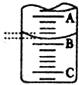
(2)如图表示50ml滴定管中液面的位置,若A与C刻度间相差1ml,A处的刻度为25,滴定管中液面读数为25.40ml.此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为Vml,NaOH标准液浓度为C mol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/ml | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(可以不必化简):$\frac{(25.28+25.32)×c×0.1×60}{2V}$
(酸度:每100ml溶液中含有溶质酸的质量,单位:g/100ml)
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
回答下列问题:
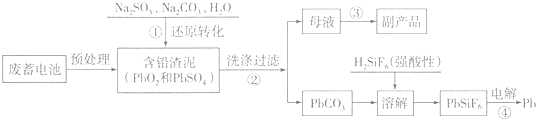
(1)写出步骤①中PbSO4转化为PbCO3过程的平衡常数表达式K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$,为提高步骤①的反应速率和铅浸出率,你认为可采取的两条措施是充分搅拌、适当升高温度.
(2)步骤①中发生的氧化还原反应的离子方程式为PbO2+SO32-+H2O=PbSO4+2OH-.
(3)写出步骤④用惰性电极电解的阴极反应式Pb2++2e-=Pb.
(4)PbO2在加热过程发生分解的失重曲线如图1所示,已知失重曲线上的a点为样品失重4.0%(即$\frac{样品起始质量-a点固体质量}{样品起始质量}$×100%)的残留固体,若a点固体组成表示为PbOx,计算x=1.4.
(5)铅的加工同样会使水体中重金属铅的含量增大造成严重污染.水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-.各形态的浓度分数α随溶液pH变化的关系如图2所示,某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如表
| 离子/(mol.L-1) | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度 | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度 | 0.004 | 22.6 | 0.040 | 0.053 | 49.9 |
A.4~5 B.6~7 C.9~10 D.11~12.
 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.