题目内容
由Na2O2?Na2CO3?NaHCO3?NaCl中的某几种组成的混合物,向其中加入足量的盐酸有气体放出?将气体通过足量的NaOH溶液,气体体积减少一部分?将上述混合物在空气中加热,有气体放出,下列判断正确的是( )
A.混合物中一定不含Na2CO3?NaCl B.混合物中一定有Na2O2?NaHCO3
C.无法确定混合物中是否含有NaHCO3 D.混合物中一定不含Na2O2?NaCl
练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.下列各组物质中,总质量一定时,不论以何种比例混合,完全燃烧生成水的质量为一常量,且与CO2的量的比值一定的一组物质是( )
| A. | 甲烷和乙烯 | B. | 乙烷和苯(C6H6) | ||
| C. | 丁烷和2-甲基丙烷 | D. | 苯和甲苯(C6H5CH3) |
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项 | 试剂 | 试纸或试液 | 现象 | 结论 |
A | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
B | 浓盐酸、浓硫酸 | pH试纸 | 变红 | HCl为酸性气体 |
C | 浓盐酸、二氧化锰 | 淀粉碘化钾试液 | 变蓝 | Cl2具有氧化性 |
D | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为( )
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
3. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
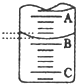
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,
A处的刻度为25,滴定管中液面读数应为25.40mL.,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准漓浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(不必化简):$\frac{\frac{25.28+25.32}{2}×c×0.1×60}{2V}$.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL,滴定管中液面的位置,若A与C刻度间相差1mL,
A处的刻度为25,滴定管中液面读数应为25.40mL.,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准漓浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中总酸度的表达式(不必化简):$\frac{\frac{25.28+25.32}{2}×c×0.1×60}{2V}$.
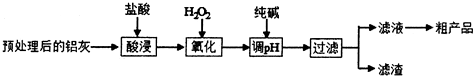
20.铝鞣剂在皮革工业有广泛应用.某学习小组以铝灰(主要成分是Al、A12O3、FeO、SiO2等)为原料制备铝鞣剂[Al(OH)2Cl],设计工艺流程如图所示:
已知:
请回答下列问题:
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是温度太低,反应慢;温度太高,盐酸挥发快.
(2)氧化时的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)调节溶液的pH范围为2.8<pH<3.4.
(4)滤渣中主要含有物质的化学式是SiO2、Fe(OH)3.

已知:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是温度太低,反应慢;温度太高,盐酸挥发快.
(2)氧化时的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)调节溶液的pH范围为2.8<pH<3.4.
(4)滤渣中主要含有物质的化学式是SiO2、Fe(OH)3.
18.如表离子能大量共存,且满足相应要求的是( )
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
| D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
| A. | A | B. | B | C. | C | D. | D |


 充分反应测定生成气体的体积
充分反应测定生成气体的体积 充分反应测定剩余固体的质量
充分反应测定剩余固体的质量 充分反应测定所得固体的质量
充分反应测定所得固体的质量