题目内容
一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表.
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A、0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) |
| B、6~10min的平均反应速率:v(H202)<3.3×10-2mol/(L?min) |
| C、反应至6min时,c(H2O2)=0.30mol/L |
| D、反应至6min时,H2O2分解了50% |
考点:反应速率的定量表示方法
专题:化学反应速率专题
分析:根据化学反应速率之比等化学计量数之比进行计算,根据化学反应的定义进行计算,得出正确结论.
解答:
解:2H202
2H2O+O2↑,
A.0~6min产生的氧气的物质的量n(O2)=
×10-3=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
≈3.3×10-2mol/(L?min),故A正确;
B.
=3.73,
=1.88,3.73>1.88,故单位时间内产生的氧气,0~6min大于6~10min,故6~10min的平均反应速率:v(H202)<3.3×10-2mol/(L?min),故B正确;
C.6min时,c(H2O2)=0.40-
=0.20mol/L,故C错误;
D.6min时,H2O2分解的分解率为:
×100%=50%,故D正确,
故选C.
| ||
A.0~6min产生的氧气的物质的量n(O2)=
| 22.4 |
| 22.4 |
| ||
| 6 |
B.
| 22.4 |
| 6 |
| 29.9-22.4 |
| 10-6 |
C.6min时,c(H2O2)=0.40-
| 0.002 |
| 0.01 |
D.6min时,H2O2分解的分解率为:
| 0.20 |
| 0.40 |
故选C.
点评:本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组中的元素用原子序数表示,其中都属于主族的一组元素是( )
| A、14、24、34 |
| B、26、31、35 |
| C、5、15、20 |
| D、11、17、18 |
下列选项中对应关系正确的是( )
A、CH3CH3+Cl2
| ||
| B、由油脂得到甘油,由淀粉得到葡萄糖;均发生了水解反应 | ||
| C、Cl2+2Br-═2Cl-+Br2,Zn+Cu2+═Zn2++Cu,均为单质被还原的置换反应 | ||
| D、2Na2O2+2H2O═4NaOH+O2↑,Cl2+H2O═HCl+HClO,均为水作还原剂的氧化还原反应 |
将漫射日光照射到装有氯气和甲烷混合气体(体积比为4:1)的装置上.现列出如下现象,其中正确的是( )
①试管内气体颜色逐渐变浅
②试管内黄绿色加深
③无任何现象
④试管内液面上升
⑤试管内壁上有油状物生成.
①试管内气体颜色逐渐变浅
②试管内黄绿色加深
③无任何现象
④试管内液面上升
⑤试管内壁上有油状物生成.
| A、①和② | B、①④和⑤ |
| C、①和⑤ | D、②和⑤ |
某校化学兴趣小组的同学将等体积的甲烷与氯气混合于一集气瓶中,用玻璃片盖严后置于光亮处,一段时间后不可能观察到的现象是( )
| A、集气瓶中气体的黄绿色逐渐变浅 |
| B、集气瓶内壁上有油状液滴附着 |
| C、集气瓶底部出现黑色颗粒 |
| D、取下玻璃片,可能会看到白雾 |
信息、材料和能源被称为新科技革命的三大支柱.下列有关说法错误的是( )
| A、复合材料保持了原材料的优点,又有优于原材料的特点 |
| B、玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁 |
| C、“神六”飞船使用了大量的复合材料 |
| D、铜是一种有色金属材料 |
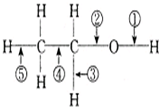 乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )
乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )