题目内容
16.通常情况下,下列各组气体不能共存的是( )| A. | N2和O2 | B. | H2和Cl2 | C. | H2和O2 | D. | NO和O2 |
分析 通常条件下不能共存说明二者常温常压下能发生化学反应,根据物质具有的性质来回答即可.
解答 解:A.N2和O2常温时不发生反应,能共存,故A不选;
B.H2和Cl2常温下不发生反应,能共存,故B不选;
C.H2和O2常温下不发生反应,能共存,故C不选;
D.NO和O2常温下能发生反应生成二氧化氮,所以二者不能共存,故D选;
故选:D.
点评 本题考查了气体能否共存,明确各种气体性质是解题关键,注意反应条件,题目难不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列说法正确的是( )
| A. | 广泛PH试纸可测定某溶液的PH值为13 | |
| B. | 将PH试纸湿润后,测得的PH值一定有误差 | |
| C. | 用PH试纸蘸取溶液,过半分钟与标准比色卡对比 | |
| D. | 精密pH试纸,测得的PH值一定不能为7.0 |
4.根据图提供的信息,下列所得结论不正确的是( )
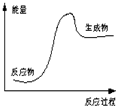

| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
11.在 2L 的密闭容器中发生反应:4A(s)+3B(g)?2C(g)+D(g),2min后B减小了 1.2mol.有关此反应的说法正确的是( )
| A. | 在 2 min 内的反应速率,用 C 表示是 0.4 mol/(L•min) | |
| B. | 分别用 B、C、D 表示化学反应速率其比值是 3:2:1 | |
| C. | 达到化学反应限度时,B 物质转化率为 100% | |
| D. | 向容器中增加 A 的投量,可以加快该反应的速率 |
8.关于烯烃和烷烃的说法正确的是( )
| A. | 单烯烃和环烷烃互为同分异构体 | |
| B. | 分子式相差一个或多个“CH2”的有机物一定互为同系物 | |
| C. | 单烯烃的通式是CnH2n,则二烯烃的通式为CnH2n-2 | |
| D. | n>2时,CnH2n+2的同分异构体比CnH2n的同分异构体多 |
5.(1)下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,⑥Na2O2溶于水.未发生化学键断裂的是①⑤;(填序号,下同)仅发生离子键断裂的是②③;仅发生共价键断裂的是④;即发生离子键断裂,又发生共价键断裂的是⑥;
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl.
(2)1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(3)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3 401 |
10.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
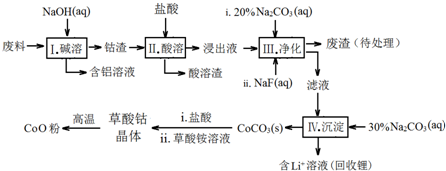
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是3.2-7.15;废渣中的主要成分为Fe(OH)3、LiF.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是3CoC2O4+2O2 $\frac{\underline{\;210℃-290℃\;}}{\;}$Co3O4+6CO2.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应调节溶液的pH范围是3.2-7.15;废渣中的主要成分为Fe(OH)3、LiF.
(4)步骤Ⅲ中NaF参与的反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,[M (CoC2O4•2H2O)=183g/mol]受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
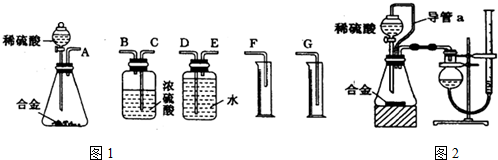
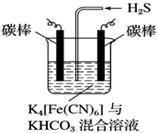 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.