题目内容
1. 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O.
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28:11,则其化学式为Fe8O11.
(3)铁及其化合物可用于消除环境污染.常温下,硫酸亚铁能将SO2转化为SO42-,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为2Fe3++SO2+2H2═2Fe2++SO42-+4H+.
(4)常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4.若2mol ZnFe2Oy与足量NO2反应可生成0.5mol N2,则y=3.
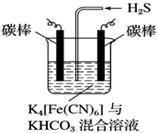
(5)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫.通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓.
电解时,阳极的电极反应式为;[Fe(CN)6]4--e-═[Fe(CN)6]3-.
分析 (1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$=8:11;
(3)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式;
(4)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断.
解答 解:(1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高,发生的离子反应为2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O,
故答案为:2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$═8:11,则化学式为Fe8O11,故答案为:Fe8O11;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
故答案为:2Fe3++SO2+2H2═2Fe2++SO42-+4H+;
(4)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
(5)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-.
点评 本题考查氧化还原反应计算及电解等,综合性较强,注重氧化还原反应应用能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.

| A. | 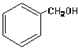 酚类-OH 酚类-OH | B. | 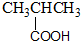 羧酸-CHO 羧酸-CHO | ||
| C. | 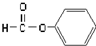 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 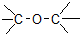 |
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨烯
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯.
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
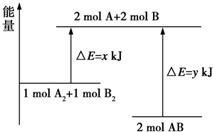
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
| A. | N2和O2 | B. | H2和Cl2 | C. | H2和O2 | D. | NO和O2 |
| A. | C6H5CH2OH | B. |  | C. |  | D. | CH3Cl |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
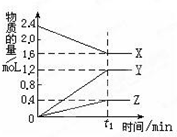 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.