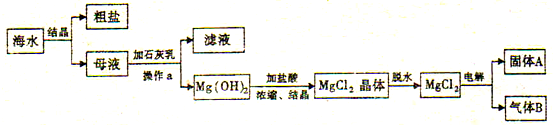
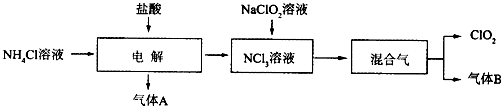
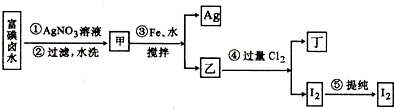
��Ŀ����
8��t��ʱ����3mol A��1mol B����ͨ�����Ϊ2L���ܱ������У��ݻ����䣩���������·�Ӧ��3A��g��+B��g��?xC��g����2minʱ�ﵽƽ��״̬���¶Ȳ��䣩��ʣ��0.8mol B�������C��Ũ��Ϊ0.4mol/L������д���пհף���1���ӿ�ʼ��Ӧ��ƽ��״̬������C��ƽ������Ϊ0.2 mol•L-1•min-1��
��2��x=4��
��3����������ԭƽ�������������ͨ��������������ѧƽ��C��
A��������Ӧ�����ƶ��� B�����淴Ӧ�����ƶ��� C�����ƶ���
���� ��1������v=$\frac{��c}{��t}$����v��C����
��2���μӷ�ӦBΪ1mol-0.8mol=0.2mol���ٸ���n=cV��������C�����ʵ������������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
��3�����º����£�ͨ�뺤������Ӧ�����Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
��� �⣺��1����c=0.4mol•L-1��2min=0.2 mol•L-1•min-1��
�ʴ�Ϊ��0.2 mol•L-1•min-1��
��2���μӷ�ӦBΪ1mol-0.8mol=0.2mol������C�����ʵ���Ϊ2L��0.4mol/L=0.8mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���1��x=0.2��0.8�����x=4��
�ʴ�Ϊ��4��
��3�����º����£�ͨ�뺤����A��B��C��Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
��ѡ��C��
���� ���⿼�黯ѧƽ�������Ӱ�����أ��Ƚϻ�����ע������ѹǿ�ı�Ӱ��ƽ���ƶ�������Ӱ������Ũ�ȣ�

��ϰ��ϵ�д�
�����Ŀ
18��Ϊ�˼������������ŷţ��й�������ŵ��2020���ҹ���λ����������ֵCO2�ŷű�2005���½�40%-45%��Ŀǰ��ҵ���в���CO2��H2��CuO-ZnO/ZrO���·�Ӧ�Ʊ���Ҫ����ԭ��CH3OH�Ĺ��գ�CO2��g��+3H2��g��?CH3OH��g��+H2O��g������H��Ϊ̽���䷴Ӧԭ����������ʵ�飬���ݻ�Ϊ2L�ܱ������ڡ�250��������n��CO2�� ��n��H2����ʱ��ı仯������±���
��ƽ��ʱ��Ӧ������4.9kJ��������Ŀ�ش��������⣺
��1��n1=0.93��250���£��÷�Ӧ��ƽ�ⳣ��K=13.7����H=-49kJ/mol��
��2��ƽ��ʱCO2��ת������25%��
��3����˵����Ӧ�Ѵ�ƽ��״̬����BC��
A��v��H2��=3v��CO2�� B��������ѹǿ���ֲ���
C��v����CO2��=v����CH3OH�� D���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����C��
A����ʱ��������� B���ʵ������¶� C������CO2Ũ�� D��ѡ���Ч����
��5����̼����������ָͨ��һ���ķ�������ҵ�����в�����CO2������������ã��������NaOH��Һ��������CO2�������������ͼ��ʾ���������õ���ʯ�ң���������������δ�������
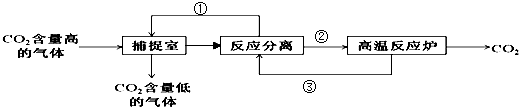
���ʢ�ΪNaOH�����ʢ�ΪCaO��������Ϊ���ˣ��������̷����Ļ�ѧ��Ӧ����ʽ�У�2NaOH+CO2=Na2CO3+H2O��CaO+H2O=Ca��OH��2��Ca��OH��2+Na2CO3=CaCO3��+2NaOH��
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��CO2����mol�� | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n��H2����mol�� | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
��1��n1=0.93��250���£��÷�Ӧ��ƽ�ⳣ��K=13.7����H=-49kJ/mol��
��2��ƽ��ʱCO2��ת������25%��
��3����˵����Ӧ�Ѵ�ƽ��״̬����BC��
A��v��H2��=3v��CO2�� B��������ѹǿ���ֲ���
C��v����CO2��=v����CH3OH�� D���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����C��
A����ʱ��������� B���ʵ������¶� C������CO2Ũ�� D��ѡ���Ч����
��5����̼����������ָͨ��һ���ķ�������ҵ�����в�����CO2������������ã��������NaOH��Һ��������CO2�������������ͼ��ʾ���������õ���ʯ�ң���������������δ�������

���ʢ�ΪNaOH�����ʢ�ΪCaO��������Ϊ���ˣ��������̷����Ļ�ѧ��Ӧ����ʽ�У�2NaOH+CO2=Na2CO3+H2O��CaO+H2O=Ca��OH��2��Ca��OH��2+Na2CO3=CaCO3��+2NaOH��
19�� 2015��10��26�գ������Ϻ��뺼�ݵĻ����Ǽʸ�����ʽ��ͨ��Ӫ�����Ϻ�������ֻ��Ҫ45���ӣ���ҵ���������ȷ�Ӧ���Ӹֹ��ķ�϶����Ӧ����ʽ���£�
2015��10��26�գ������Ϻ��뺼�ݵĻ����Ǽʸ�����ʽ��ͨ��Ӫ�����Ϻ�������ֻ��Ҫ45���ӣ���ҵ���������ȷ�Ӧ���Ӹֹ��ķ�϶����Ӧ����ʽ���£�
2Al+Fe2O3 $\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3������Fe2O3�ǣ�������
 2015��10��26�գ������Ϻ��뺼�ݵĻ����Ǽʸ�����ʽ��ͨ��Ӫ�����Ϻ�������ֻ��Ҫ45���ӣ���ҵ���������ȷ�Ӧ���Ӹֹ��ķ�϶����Ӧ����ʽ���£�
2015��10��26�գ������Ϻ��뺼�ݵĻ����Ǽʸ�����ʽ��ͨ��Ӫ�����Ϻ�������ֻ��Ҫ45���ӣ���ҵ���������ȷ�Ӧ���Ӹֹ��ķ�϶����Ӧ����ʽ���£�2Al+Fe2O3 $\frac{\underline{\;����\;}}{\;}$2Fe+Al2O3������Fe2O3�ǣ�������
| A�� | ������ | B�� | �������������ǻ�ԭ�� | ||
| C�� | ��ԭ�� | D�� | �Ȳ����������ֲ��ǻ�ԭ�� |
16��ÿ��6��5��Ϊ���绷���գ������йػ������鲻�ܲ��ɵ��ǣ�������
| A�� | ��������̫���� | B�� | �ᳫ�������ദ�� | ||
| C�� | �Ľ�����β���������� | D�� | ����ҵ��ˮֱ���ŷ� |
13���������л���Ľṹ�������йص�������ȷ���ǣ�������
| A�� | ������ϩ����ʹ��ˮ��ɫ���ҷ�Ӧԭ����ͬ | |
| B�� | ��Ȳ�ͱ���Ϊ������������ֻ�ܷ����ӳɷ�Ӧ | |
| C�� | ����ʽΪC10H14 ������ֻ��һ��ȡ�����ķ�����������ܵĽṹ��3�� | |
| D�� | ��ϩ������ϩ������ͨ���ۺϷ�Ӧ�õ��߷��Ӳ��� |
18�����и����ӷ���ʽ�У�����ˮ�ⷴӦ���ǣ�������
| A�� | HCO3-+H2O?H3O++CO32- | B�� | NH4++H2O?NH3•H2O+OH- | ||
| C�� | PO43-+H2O?HPO42-+OH- | D�� | H2O+H2O?H3O++OH- |