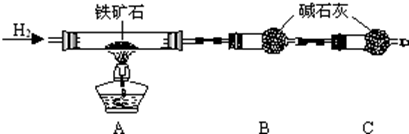
题目内容
20.世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯.二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热.实验室以电解法制备ClO2的流程如下: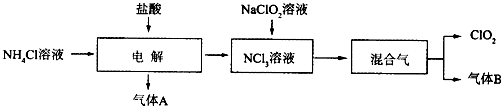
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定.②气体B能使湿润的红色石蕊试纸变蓝.
回答下列问题:
(1)电解时,发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑.实验室制备气体B的化学方程式为2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②控制好反应温度.
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-.
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液,为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10mL,稀释成100mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30min.
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL.(已知I2+2
S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是最后一滴滴入后,溶液从蓝色变成无色,且30s内不变色;
②根据上述步骤可计算出原ClO2溶液的浓度为$\frac{135c{V}_{2}}{{V}_{1}}$g/L(用含字母的代数式表示).
分析 NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水;
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH;
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色褪去;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,据此计算V1 mL试样中ClO2的物质的量,进而计算100mL溶液中ClO2的物质的量,再结合m=nM计算原10mL溶液中ClO2的浓度.
解答 解:NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$NCl3+3H2↑;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH,反应离子方程式为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
故答案为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色变为无色,且30s内不变色,说明反应到达终点,
故答案为:溶液蓝色变为无色,且30s内不变色;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为为c mol/L×V2×10-3L×5×$\frac{100mL}{{V}_{1}mL}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$×68.5g/mol,
ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$×67.5g/mol=cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g,即原溶液中ClO2的浓度为(cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g)÷0.01L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$.
点评 本题考查物质制备,为高频考点,涉及氧化还原反应滴定、离子方程式书写、电解原理等知识点,明确实验原理、物质性质、实验基本操作等是解本题关键,同时还考查计算能力,知道流程图中发生的反应及基本操作方法、物质成分等,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 磷(P)基态原子最外层轨道表示式: | |
| B. | 钢铁发生吸氧腐蚀的正极反应式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的实验式:C6H12O6 | |
| D. | 氰基的电子式: |
| A. | 原子半径:S>O>N | B. | 沸点:H2O>HF>H2S | ||
| C. | 离子半径:Cl->Al3+>Mg2+ | D. | 还原性:I->S2->Br- |

 铁是目前人类使用量最大的金属,它能形成多种化合物.
铁是目前人类使用量最大的金属,它能形成多种化合物.