题目内容
12.化学反应速率的变化和化学平衡移动的规律都可以通过实验得出结论,勒夏特列原理也是由实验总结出来的.(1)将铜片投入到稀硝酸中,开始时产生气泡的速率很慢,随后反应速率增大,根据你学到的知识分析,反应速率增大的原因是该反应是放热反应.当进行一段时间后,反应速率又减慢,这次速率减慢的原因是随着反应的进行,硝酸的浓度减小.
(2)丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++I-.25℃时,该反应的速率由下列经验公式决定:
υ=k•c(CH3COCH3)•c(H+)[mol/(L•s)]
根据该经验公式,如果c(I2),c(CH3COCH3),c(H+)的起始浓度依次为0.01mol/L,0.1mol/L,0.01mol/L,分析反应速率的变化趋势是先逐渐增大后逐渐减小.
(3)在一支试管中先加入30mL 0.01mol/L FeCl3溶液,再滴加10mL 0.01mol/L KSCN溶液,摇匀.将制得的溶液平均分装于4支试管中,然后分别加入:①FeCl3固体;②KSCN固体;③KCl固体;④H2O.充分振荡后,溶液的颜色基本不变的是③(填序号).
(4)在50mL的注射器中吸入40mL NO2和N2O4的混合气体,在另一同样规格的注射器中吸入40mL Br2(g),对比两注射器中气体的颜色完全一致.然后都将注射器的活塞慢慢推至20mL处,发现注射器内气体的颜色变化的现象是前者先变深后变浅,但比原来深;后者只变深.推测平衡移动是通过观察装入NO2和N2O4的混合气体的注射器内气体的颜色比装入Br2(g)的注射器内气体的颜色浅.
(5)如果要鉴别密封于由两球连通的密闭容器中充满的红棕色气体是NO2和N2O4混合气还是Br2(g),可以通过加热.
分析 (1)铜与稀硝酸是放热反应,温度升高,速率加快;稀硝酸被消耗,浓度变小,速率减慢;
(2)根据三段法计算当溶液中的I2消耗较少和较多时,c(CH3COCH3)、c(H+)的浓度大小,代入v=kc(CH3COCH3)•c(H+)mol/(L•s)计算、比较得出;
(3)溶液中存在平衡Fe3++3SCN-?Fe(SCN)3,
①加入氯化铁,增大反应物浓度,平衡向正反应方向移动;
②加入硫氰化钾,增大反应物浓度,平衡向正反应方向移动;
③加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
④加入水,导致Fe3+浓度降低,平衡向逆方向移动;
(4)减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析平衡向气体体积减小的分析进行;
(5)根据化学平衡移动原理分析,对于可逆反应2NO2?N2O4,逆方向为吸热反应,升温平衡向吸热方向移动,颜色加深.
解答 解:(1)铜与稀硝酸是放热反应,温度升高,速率加快;随反应的进行,稀硝酸被消耗,浓度变小,速率减慢,
故答案为:该反应是放热反应;随着反应的进行,硝酸的浓度减小;
(2)反应开始时c(CH3COCH3)=0.1 mol/L,c(H+)=0.01 mol/L,所以v0=0.1×0.01k mol/(L•s)=0.001k mol/(L•s),
当溶液中的I2消耗0.001 mol/L,
CH3COCH3+I2→CH3COCH2I+H++I-
开始:0.1 0.01 0.01
变化:0.001 0.001 0.001
结束:0.099 0.009 0.011
此时v=0.099×0.011k mol/(L•s)=0.001089k mol/(L•s)>0.001k mol/(L•s),所以反应开始时,反应速率逐渐增大,
当溶液中的I2消耗一半时,
CH3COCH3+I2→CH3COCH2I+H++I-
开始:0.1 0.01 0.01
变化:0.05 0.005 0.005
结束:0.05 0.005 0.015
此时v=0.05×0.015k mol/(L•s)=0.00075k mol/(L•s)<0.001k mol/(L•s),反应一段时间后,反应速率逐渐减小,
故答案为:先逐渐增大后逐渐减小;
(3)溶液中存在平衡Fe3++3SCN-?Fe(SCN)3,
①加入氯化铁,增大反应物浓度,平衡向正反应方向移动,颜色加深,故不选;
②加入硫氰化钾,增大反应物浓度,平衡向正反应方向移动,颜色加深,故不选;
③加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,颜色不改变,故可选;
④加入水,导致Fe3+浓度降低,平衡向逆方向移动,颜色变浅,故不选;
故答案为:③;
(4)压缩前者注射器到20mL时,NO2浓度增大,则气体颜色加深,气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度略降低,所以气体颜色变浅,但仍比开始气体的颜色深;后者无平衡移动,颜色只加深,对比两个实验可知前者的颜色比后者浅,
故答案为:前者先变深后变浅,但比原来深;后者只变深;浅;
(5)根据化学平衡移动原理分析,对于可逆反应2NO2?N2O4,逆方向为吸热反应,升温平衡向吸热方向移动,所以可以加热两个装置,颜色加深的是NO2和N2O4混合气,而装溴蒸气的装置颜色不改变,故答案为:通过加热.
点评 本题考查了化学平衡及其影响,题目难度不大,明确发生反应的实质为解答关键,注意掌握化学平衡及其影响因素,试题侧重基础知识的考查,培养了学生的灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 在氧化还原反应中,还原剂一定是失去电子的反应物 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态转变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
| A. | 滤渣中一定有银,没有铜和锌 | |
| B. | 滤渣中一定有银和锌,可能有铜 | |
| C. | 滤液中一定有硝酸锌、硝酸铜、硝酸银 | |
| D. | 滤液中一定有硝酸锌、硝酸铜,可能有硝酸银 |
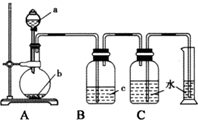 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 发现操作失误,应该重做实验 | |
| B. | 测定结果有偏差,也要记录在实验报告上 | |
| C. | 误差分析后,可更改数据 | |
| D. | 实验报告不能预先完全做好 |
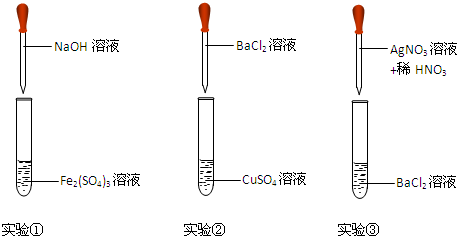
| 编号 | 现象 | 离子方程式 |
| ① | ||
| ② | ||
| ③ |
 .
.