题目内容
20.取某白色固体,分成等质量的两份,一份固体与过量的氢氧化钠溶液加热反应,放出能使湿润的红色石蕊试纸变蓝的气体,这些气体恰好能与30mL 0.1mol/L H2SO4 完全反应;另一份固体与足量的盐酸反应,放出无色无臭的气体,这些气体通入过量的澄清石灰水产生0.4克沉淀. 这种白色固体中所含阴、阳离子的物质的量之比2:3.推断该白色固体是等物质的量混合的(NH4)2CO3和NH4HCO3.分析 固体与碱液共热时放出能使湿润红色石蕊试纸变蓝的气体,证明有NH4+存在,这些气体恰好能和30mL0.1mol/L的硫酸溶液完全反应,则n(NH4+)=2×n(H2SO4)=2×0.1mol/L×0.03L=0.006mol;固体与酸反应所生成的无色无臭气体能与石灰水作用产生白色沉淀,证实固体中有CO32-或HCO3-,n(CO32-或HCO3-)=n(CaCO3)=$\frac{0.4g}{100g/mol}$=0.004mol,以此来解答.
解答 解:固体与碱液共热时放出能使湿润红色石蕊试纸变蓝的气体,证明有NH4+存在,这些气体恰好能和30mL0.1mol/L的硫酸溶液完全反应,则n(NH4+)=2×n(H2SO4)=2×0.1mol/L×0.03L=0.006mol;固体与酸反应所生成的无色无臭气体能与石灰水作用产生白色沉淀,证实固体中有CO32-或HCO3-,n(CO32-或HCO3-)=n(CaCO3)=$\frac{0.4g}{100g/mol}$=0.004mol,则该固体中阴阳离子物质的量之比为0.004mol:0.006mol=2:3,
由阴阳离子物质的量之比可知,该固体为(NH4)2CO3和NH4HCO3的混合物,
设(NH4)2CO3的物质的量为x,NH4HCO3的物质的量为y,根据铵根离子和C原子守恒得,
$\left\{\begin{array}{l}{x+y=0.004}\\{2x+y=0.006}\end{array}\right.$,解得x=0.002mol、y=0.002mol,
白色固体为等物质的量混合的(NH4)2CO3和NH4HCO3,
故答案为:2:3;等物质的量混合的(NH4)2CO3和NH4HCO3.
点评 本题考查无机物的推断,为高频考点,把握离子的检验、固体组成的计算等为解答的关键,侧重分析与推断能力的考查,注意结合原子守恒判断混合物的组成,题目难度不大.

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | CO2的结构式:O=C=O | B. | 乙醇分子的球棍模型: | ||
| C. | Cl-结构示意图: | D. | 四氯化碳的电子式: |
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KClO3、浓盐酸 | Cl2、… |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中还原产物是KCl,生成3 mol Cl2转移电子6mol | |
| D. | 氧化性由强到弱顺序为ClO3->Cl2>Br2>Fe3+ |
| A. | 常温常压下,2.24LNH3中含有共价键0.3mol | |
| B. | 该反应过程中,每生成1mol NaNH2,转移电子2mol | |
| C. | 在该反应条件下,Na的还原性强于H2 | |
| D. | 该反应过程中熵减,所以高温条件下能自发进行 |
| A. | 用坩埚钳夹住一小块铝箔加热至其熔化,熔化的铝不滴落是因为反应生成熔点很高的Al2O3薄膜 | |
| B. | 氯化铝溶液中加入过量氨水的离子方程式为:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| C. | 将AlCl3溶液滴入浓的NaOH溶液中,立即产生大量的白色沉淀 | |
| D. | 可用过量氨水除去Fe3+溶液中的少量Al3+杂质 |
| A. | 盐汽水 | B. | 矿泉水 | C. | 自来水 | D. | 蒸馏水 |
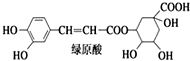
| A. | 分子中可能有 16 个碳原子在同一平面内 | |
| B. | 1 mol 绿原酸与足量溴水反应,最多消耗 4 mol Br2 | |
| C. | 1 mol 绿原酸与足量 NaOH 溶液反应,最多消耗 7 mol NaOH | |
| D. | 绿原酸水解产物均可以与 FeCl3溶液发生显色反应 |
| A. | 在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,粉状的反应速率快 | |
| B. | 将相同大小、相同面积的镁条和铝条与相同浓度的盐酸反应,前者速率大于后者 | |
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 | |
| D. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |