题目内容
17.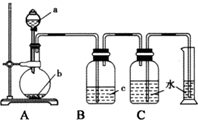 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图可知,为固体、液体反应且不加热制备气体,c中液体可除杂,气体不溶于水,最后利用排水法测定其体积,以此来解答.
解答 解:A.稀盐酸与Zn反应生成氢气,浓硫酸不能除去HCl,故A不选;
B.浓硫酸与氨气反应,且氨气易溶于水,不能排水法测定气体的体积,故B不选;
C.饱和食盐水与电石反应生成的乙炔中混有硫化氢,硫酸铜溶液除去硫化氢,乙炔不溶于水,排水法测定其体积,故C选;
D.Cu与浓硫酸反应需要加热,图中无加热仪器,故D不选;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握气体的制备实验、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
7.下列各表述与示意图一致的是( )
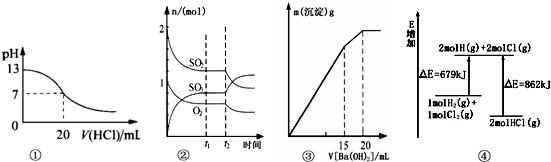

| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 | |
| B. | 图②表示一定条件下进行的反应2SO2(g)+O2(g)?2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 | |
| C. | 图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 图④表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
8.已知放热反应:2Na+2NH3(l)=2NaNH2+H2↑,下列说法正确的是( )
| A. | 常温常压下,2.24LNH3中含有共价键0.3mol | |
| B. | 该反应过程中,每生成1mol NaNH2,转移电子2mol | |
| C. | 在该反应条件下,Na的还原性强于H2 | |
| D. | 该反应过程中熵减,所以高温条件下能自发进行 |
5.属于纯净物的是( )
| A. | 盐汽水 | B. | 矿泉水 | C. | 自来水 | D. | 蒸馏水 |
2.设NA为阿伏加德罗常数值.下列有关叙述错误的是( )
| A. | 2.3 g Na在足量O2中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6 L NHs中含有的氢原子数目为0.75NA | |
| C. | 1 L 0.1 mol/LH3PO4溶液中含有的离子数目为0.4NA | |
| D. | 1个CO2分子的质量为$\frac{44}{{N}_{A}}$g |
9.绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
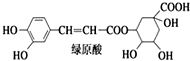
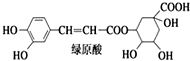
| A. | 分子中可能有 16 个碳原子在同一平面内 | |
| B. | 1 mol 绿原酸与足量溴水反应,最多消耗 4 mol Br2 | |
| C. | 1 mol 绿原酸与足量 NaOH 溶液反应,最多消耗 7 mol NaOH | |
| D. | 绿原酸水解产物均可以与 FeCl3溶液发生显色反应 |
6.小李学习了水的有关知识后,自制了如图所示的简易净水器,下列说法正确的是( )
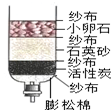

| A. | 该净水器中的活性炭起吸附作用 | B. | 该净水器可以降低自来水的硬度 | ||
| C. | 该净水器能起到杀菌消毒的作用 | D. | 该净水器可将自来水变为蒸馏水 |