题目内容
2.下列叙述正确的是( )| A. | 在氧化还原反应中,还原剂一定是失去电子的反应物 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态转变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
分析 A.氧化剂、还原剂可能为同种物质;
B.非金属单质可能为还原剂;
C.某元素从化合态转变为游离态时,可能被氧化或被还原;
D.金属阳离子被还原,可能为金属阳离子.
解答 解:A.氧化剂、还原剂可能为同种物质,如氯气与NaOH的反应中,氯气失去电子也得到电子,故A错误;
B.非金属单质可能为还原剂,如C与水蒸气的反应中,C为还原剂,故B错误;
C.某元素从化合态转变为游离态时,可能被氧化或被还原,如硫化氢与二氧化硫反应生成S,故C错误;
D.金属阳离子被还原,可能为金属阳离子,如铁离子得到电子转化为亚铁离子,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、基本概念等为解答的关键,侧重分析与应用能力的考查,注意结合实例分析,题目难度不大.

练习册系列答案
相关题目
13.下列离子方程式中,书写不正确的是( )
| A. | 常温下,Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 稀H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
10.下列化学用语不正确的是( )
| A. | CO2的结构式:O=C=O | B. | 乙醇分子的球棍模型: | ||
| C. | Cl-结构示意图: | D. | 四氯化碳的电子式: |
17.某溶液仅含如表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol.
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
(1)原溶液中含有的阳离子是Fe2+、Mg2+; 含有的阴离子是Cl-、NO3-、SO42-.
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
| 阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | OH- CO32- Cl- NO3- SO42- |
②若向原溶液中加入少量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变.
请推断:
(1)原溶液中含有的阳离子是Fe2+、Mg2+; 含有的阴离子是Cl-、NO3-、SO42-.
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
7.下列各表述与示意图一致的是( )
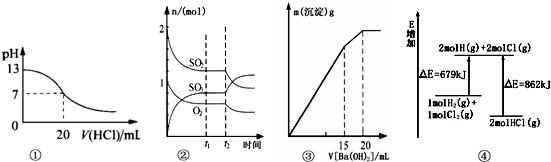

| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 | |
| B. | 图②表示一定条件下进行的反应2SO2(g)+O2(g)?2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 | |
| C. | 图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 图④表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
14.设NA为阿伏加德罗常数值.下列有关叙述错误的是( )
| A. | 14 g乙烯和丙烯混合气体中的氢原子数为NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数小于2NA | |
| C. | 1 mol Fe溶于过量硝酸,电子转移数为3NA | |
| D. | 标准状况下,2.24 L CH4含有的共价键数为0.4NA |
11.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | KClO3、浓盐酸 | Cl2、… |
| A. | 第①组反应的其余产物为H2O和O2 | |
| B. | 第②组反应中Cl2与FeBr2的物质的量之比为1:2 | |
| C. | 第③组反应中还原产物是KCl,生成3 mol Cl2转移电子6mol | |
| D. | 氧化性由强到弱顺序为ClO3->Cl2>Br2>Fe3+ |
