题目内容
4.过硫酸钠( Na2S2O8)是一种重要化工原料.某研究小组进行如下实验对过硫酸钠的制取和性质进行探究:[查阅资料]①(NH4)2S2O8+2NaOH $\frac{\underline{\;55℃\;}}{\;}$Na2S2O8+2NH3↑+2H2O
②2NH3+3Na2S2O8十6NaOH $\frac{\underline{\;90℃\;}}{\;}$6Na2SO4+6H2O十N2
[制备产品]
I采用如图装置制取Na2S2O8.

(1)装置Ⅱ的作用是吸收NH3.
(2)装置I中盛NaOH溶液的仪器名称是分液漏斗 装置I还需补充的实验仪器或装置有a、b、c(填下列序号).
a.温度计 b.酒精灯 c.盛热水浴的水槽 d.洗气瓶
(3)装置I发生反应的同时需要持续通入N2的目的是使三颈烧瓶内产生的NH3及时排除,减少副反应②的发生
Ⅱ.采用电解法制取Na2S2O8
(4)用惰性电极如铂电解KHSO4溶液,阴极上产生无色无味的气体,阳极上HSO4-被氧化生成过硫酸根.其化学方程式为2KHSO4$\frac{\underline{\;电解\;}}{\;}$K2S2O8+H2↑.
[探究与反思]
(5)Na2S2O8溶液与铜只生成两种盐,其化学方程式为K2S2O8+Cu=K2SO4+CuSO4.观察时发现反应先慢后快,对此甲、乙两同学提出以下两种假设:
甲:可能是该反应放热,使溶液温度逐渐升高,因此先慢后快.
乙:可能是该反应生成的Cu2+对该反应起催化作用.
实验验证】该小组为验证乙的假设,分别取3.2gCu置于大试管中,进行了如下实验.可选用的试剂有:5mol/LNa2S2O8溶液、0.1mol/L CuSO4溶液、0.1mol/L Cu(NO3)2溶液、
蒸馏水.
| 实验编号 | 操作 | 现象及结论 |
| a | 加入2mL蒸馏水,再加入10mL 5mol/L Na2S2O8溶液,振荡 | 红色固体逐渐溶解,先慢后快. |
分析 根据实验原理可知,用(NH4)2S2O8和氢氧化钠反应生成Na2S2O8,由于NH3能与Na2S2O8反应,所以实验中要用氮气把生成的氨气及明排出容器,生成的氨气可以用硫酸吸收,氨气极易溶于水,所以要用防倒吸装置,
(1)根据上面的分析可知,装置Ⅱ是吸收氨气尾气的;
(2)根据装置图可知仪器名称;根据题意该反应是在55℃条件下进行,所以要用水浴加热;
(3)NH3能与Na2S2O8反应,所以要及时排出;
(4)用惰性电极如铂电解KHSO4溶液,阳极上HSO4-被氧化生成过硫酸根,根据电荷守恒和元素守恒书写电解反应式;
(5)Na2S2O8溶液与铜只生成两种盐,根据电子得失守恒和元素守恒可知,这两种物质应为硫酸钾和硫酸铜,据此书写化学方程式;根据影响反应速率的因素推断甲反应为放热反应;
解答 解:(1)根据上面的分析可知,装置Ⅱ是吸收氨气尾气的,
故答案为:吸收NH3;
(2)根据装置图可知装置I中盛NaOH溶液的仪器名称是分液漏斗,根据题意该反应是在55℃条件下进行,所以要用水浴加热,要用到温度计、酒精灯、盛热水浴的水槽,故选abc,
故答案为:分液漏斗;abc;
(3)NH3能与Na2S2O8反应,所以要及时排出,所以需要持续通入N2的目的是使三颈烧瓶内产生的NH3及时排除,减少副反应②的发生,
故答案为:使三颈烧瓶内产生的NH3及时排除,减少副反应②的发生;
(4)用惰性电极如铂电解KHSO4溶液,阳极上HSO4-被氧化生成过硫酸根,反应的化学反应式为2KHSO4$\frac{\underline{\;电解\;}}{\;}$ K2S2O8+H2↑,
故答案为:2KHSO4$\frac{\underline{\;电解\;}}{\;}$ K2S2O8+H2↑;
(5)Na2S2O8溶液与铜只生成两种盐,根据电子得失守恒和元素守恒可知,这两种物质应为硫酸钾和硫酸铜,化学方程式为K2S2O8+Cu=K2SO4+CuSO4,根据影响反应速率的因素推断甲反应为放热反应,
故答案为:K2S2O8+Cu=K2SO4+CuSO4;放热.
点评 本题考查物质制备及性质实验的操作,明确制取的原理以及氯气的性质等是解题关键,题目综合性强,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 该反应是氧化还原反应 | |
| B. | 该反应的△H<0 | |
| C. | 生成新物质的化学式为 Fe2S3 | |
| D. | 生成新物质的总能量低于反应物铁粉和硫粉的总能量 |
【猜想】猜想1:可以减少汽车尾气的污染;
猜想2:可以产生更多的热量,增强汽车的动力.
【设计与实验】
| 序号 | 实验步骤 | 实验现象 | 结论 |
| Ⅰ | 在两个蒸发皿中各加入10mL冷水,控制相同燃烧条件,分别用乙醇和汽油作为燃料进行加热,记录从开始到水沸腾的时间. | 用乙醇加热耗时118s;用汽油加热耗时56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 实验Ⅰ停止加热后,取下蒸发皿,观察蒸发皿的底部. | 用乙醇加热的蒸发皿底部只有及少量炭黑,而用汽油加热的蒸发皿底部有大量的炭黑. | 猜想1成立(可仿照上格填写) |
(1)实验Ⅰ是一个对比实验,实验过程中不一定控制的条件是B(填序号);
A.水的初始温度必须相同 B.加热开始计时点必须相同
C.燃具产生火焰的大小必须相同 D.蒸发皿的大小必须相同
(2)汽车的发动机、排气管等部件易出现积炭,使用乙醇汽油后,这些部件产生的积炭量将减少;
(3)目前乙醇汽油中乙醇的添加量约为10%,可一定程度节省石油资源.结合实验Ⅰ的结论分析,如果乙醇的添加量过大,会使汽车动力减弱(填“增强”“减弱”“不变”).
 | 1.200 | 1.000 | 0.800 | 0.600 |
| 270 | 3.60 | 3.00 | 2.40 | 1.80 |
| 280 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | 升高温度或增大A的浓度都可以增大v的值 | |
| B. | 同时改变反应温度和A的浓度,v可能不变 | |
| C. | a=6.00 | |
| D. | 270<b<280 |
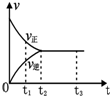 如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应N2(g)+3H2(g)?2NH3(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正反应在不断进行,速率在逐渐减小 | |
| B. | t2时,反应到达限度,在此条件下N2的转化率达到最大 | |
| C. | t2-t3,反应不再发生,各物质的物质的量保持恒定 | |
| D. | t3以后,N2(g)、H2(g)、NH3(g)的物质的量浓度相等 |
| A. | 升高温度能加快反应速率的主要原因,是增加了反应物分子中活化分子的百分数 | |
| B. | 正反应是吸热反应,达到平衡时,升高温度,v正增大,v逆减小,所以平衡向正反应方向移动 | |
| C. | 一定条件下增大反应物的量,一定会加快反应速率 | |
| D. | 对于任何一个化学反应,用其中任何一种反应物浓度的减小来表示化学反应速率,都是相同的数值 |
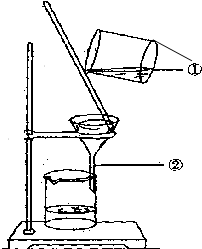 如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答:
如图为某学生进行粗盐提纯实验中过滤操作的示意图,试回答: 硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
硫酸锰铵[(NH4)2SO4•MnSO4•nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下: