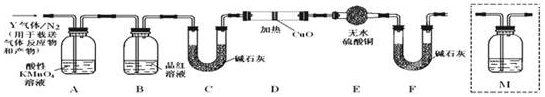
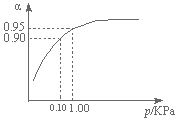
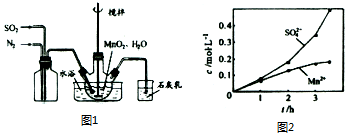
题目内容
10.设NA为阿伏加德罗常数的数值,下列说法中正确的是( )| A. | 标准状况下,22.4L氯气与足量氢氧化钠溶艘反应转移的电子数为2NA | |
| B. | 将含有1molFeCl3的饱和溶液加入到沸水中得到氢氧化铁胶体,其中胶体粒子的数目为NA | |
| C. | 两份2.7g铝分别与100 mL浓度为2mol•L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA | |
| D. | 通常情况下,16g CH4中含有4NA个C-H键 |
分析 A、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出铝的物质的量,然后根据1mol铝消耗3mol盐酸,但消耗1mol氢氧化钠来分析;
D、求出甲烷的物质的量,然后根据甲烷中含4条C-H键来分析.
解答 解:A、标况下22.4L氯气的物质的量为1mol,而氯气和碱的反应为歧化反应,且歧化为-1价和+1价,故1mol氯气转移1NA个电子,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于NA个,故B错误;
C、2.7g铝的物质的量为0.1mol,由于0.1mol铝反应需要0.3mol盐酸,而只需要0.1mol氢氧化钠,故可知盐酸的量不足,则铝在盐酸中过量,而在氢氧化钠溶液中完全反应,则转移的电子数和氢氧化钠中不同,故C错误;
D、16g甲烷的物质的量为1mol,而甲烷中含4条C-H键,故1mol甲烷中含4NA个C-H键,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
1.一定温度下,发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g);△H,已知该反应在不同温度下的平衡常数如表:
请回答下列问题:
(1)该反应的△H<0
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为α1,c(CO2)=0.15mol•L-1,则温度T低于(填高于、低于、等于)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为α2,则α1=α2(填>、<或=).
| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
(1)该反应的△H<0
(2)T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为α1,c(CO2)=0.15mol•L-1,则温度T低于(填高于、低于、等于)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为α2,则α1=α2(填>、<或=).
18.KMnO4与H2C2O4反应,生成Mn2+和CO2,酸性条件下,用0.100mol•L-1KMnO4标准溶液滴定20.00mLH2C2O4溶液,达到滴定终点时,消耗16.00mL标准溶液,则H2C2O4溶液的浓度为( )
| A. | 0.400mol•L-1 | B. | 0.300mol•L-1 | C. | 0.200mol•L-1 | D. | 0.100mol•L-1 |
5.下列有关物质的性质与用途具有对应关系的是( )
| A. | SiO2熔点高,可用作光导纤维 | |
| B. | Li还原性强且质轻,常用作负极材料 | |
| C. | Fe2(SO4)3具有氧化性,能用作净水剂 | |
| D. | SO2能杀菌,可用于漂白纸浆 |
2.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 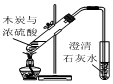 用如图所示装置验证反应产物二氧化碳 | |
| B. | 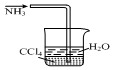 用如图装置吸收氨气并防止倒吸 | |
| C. |  如图装置配制100 mL 1 mol•L-1的硫酸 | |
| D. | 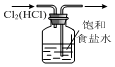 用如图装置除去氯气中的氯化氢 |


 ;
; ;
;
 .
.